大健康行业年度法律观察
大健康行业年度法律观察
纵览2022年,新冠对社会经济生活影响深刻,大健康行业更深受影响。2018年国家医保局设立,2019年《药品管理法》全面修订,大健康行业的深刻改革一直在持续推进,过去一年中,法规政策围绕走向深水区的医药医疗体制改革的方向不断出台、落地执行,相应监督执法活动亦日趋常态化、体系化。我们梳理了本年度大健康领域在法规政策、执法行动的一系列动向,并梳理业内关注重点事件,以期帮助大健康行业的企业快速了解行业发展趋势,准确把握行业合规态势。
一、法规政策篇
(一)
药品
2019年《药品管理法》(“新药法”)全面修订,从药品研发、注册、生产、流通等环节,对药事管理制度进行全面改革。随后,《药品注册管理办法》《药物临床试验质量管理规范》《药品生产监督管理办法》《药品生产质量管理规范》等陆续修订。2022年,更多细则规定推陈出新,新药法所确立的药事管理制度继续完善。
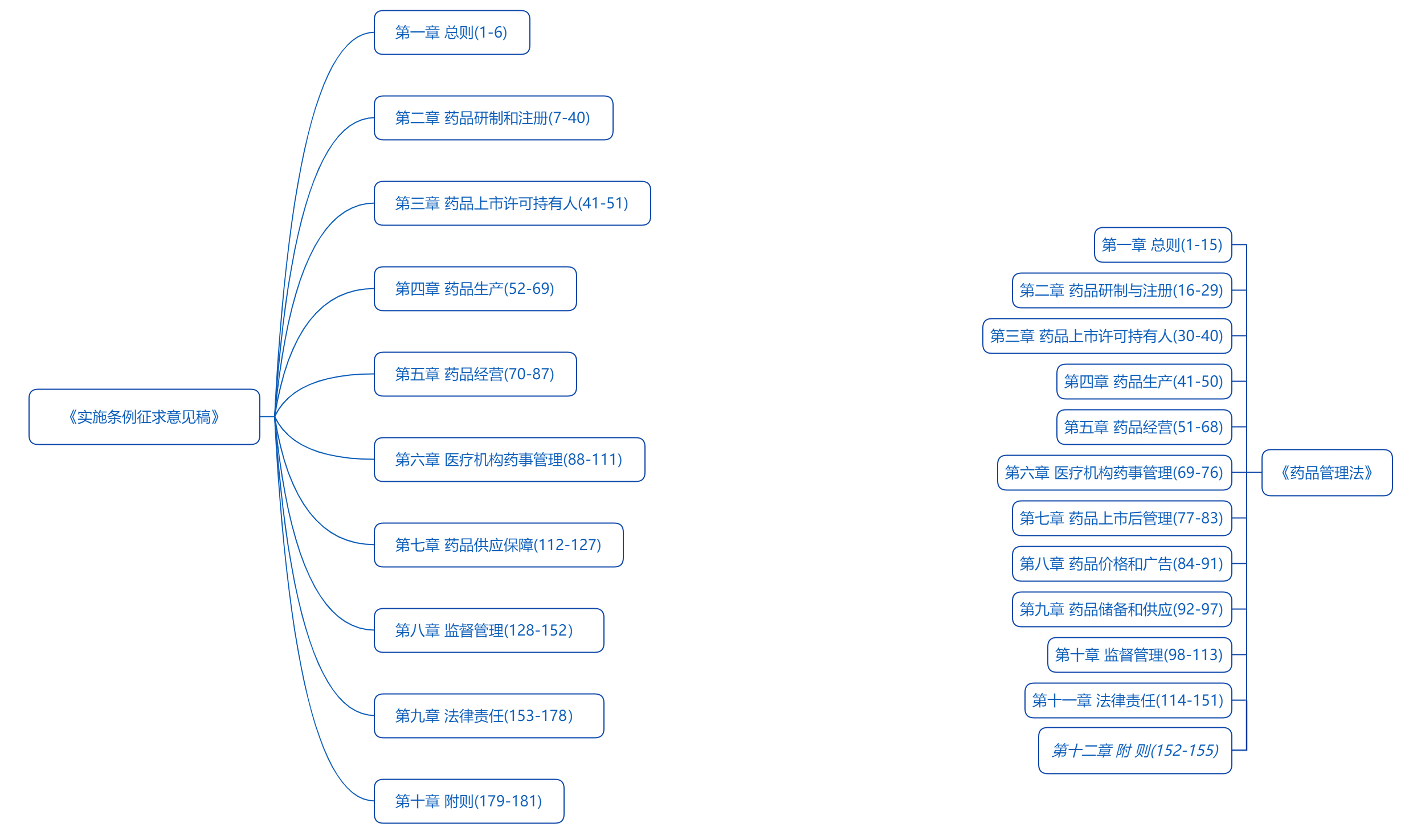
1. 2022年5月9日,国家药监局发布《药品管理法实施条例(修订草案征求意见稿)》
2022年5月9日,国家药监局综合司公开征求《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》(“《实施条例征求意见稿》”)意见。2019年《药品管理法》修改后,《药品管理法实施条例》尚未随之全面修改。此次《实施条例征求意见稿》共计十章181条,体例与《药品管理法》保持基本一致,具体条文内容包括对《药品管理法》原则性条款的细化、对既有监督管理制度的吸收、对《药品管理法》实施过程中适用问题的回应,内容丰富,且有较多创新规则,比如,在“药品研制”一节中,将药学研究与非临床研究、临床试验并列,共同作为药品研制过程的组成部分,使药品研制体系更趋完善;又如,将中药注册管理单独成立一节,中药监管更趋体系化、严格化;“药品经营”章节中,细化药品网络销售管理制度,尤其是药品零售管理制度,与已经正式发布的《药品网络销售监督管理办法》一脉相承。
点击可查看大图
2. 2022年5月27日,国家药监局发布《临床实验用药品(试行)》附录,作为GCP配套文件
临床试验用药品相较于上市产品而言,研发机构对其药品的特性、毒性了解尚不充分,制备工艺还不成熟,而临床试验用药品的质量和制备管理影响受试者安全和临床试验结果的可靠性。
在2020年之前,我国对于临床试验用药品的制备执行《药品生产质量管理规范》的要求,即并未区分临床试验用药品和已上市药品。2020年以后,新修订的《药品注册管理办法(2020)》规定临床试验用药品管理应当符合《药物临床试验质量管理规范》(“GCP”)的有关要求。然而GCP仅提及“试验药物的制备应当符合临床试验用药品生产质量管理相关要求”,缺乏可参照执行的具体细节。
今年,国家药监局参照国际通行做法,在《药品生产质量管理规范》项下为临床实验用药品制定单独附录,对临床阶段的试验用药品单独规制,为临床试验提供进一步的合规指引和便利条件。
3. 2022年7月8日,国家药监局发布《疫苗生产流通管理规定》
2019年《疫苗管理法》出台,对疫苗研制和注册、疫苗生产和批签发、疫苗流通、预防接种、异常反应监测和处理、疫苗上市后管理、保障措施、监督管理和法律责任等方面作出了相关规定。《疫苗管理法》出台后,相关的配套制度亦亟待发布。经过两次公开征求意见,国家药监局于2022年7月8日正式发布《疫苗生产流通管理规定》,进一步明确了对于疫苗生产和流通环节的监管要求,比如疫苗委托生产的具体落地实施方式,包括委托生产适用的情形、委托生产流程等。
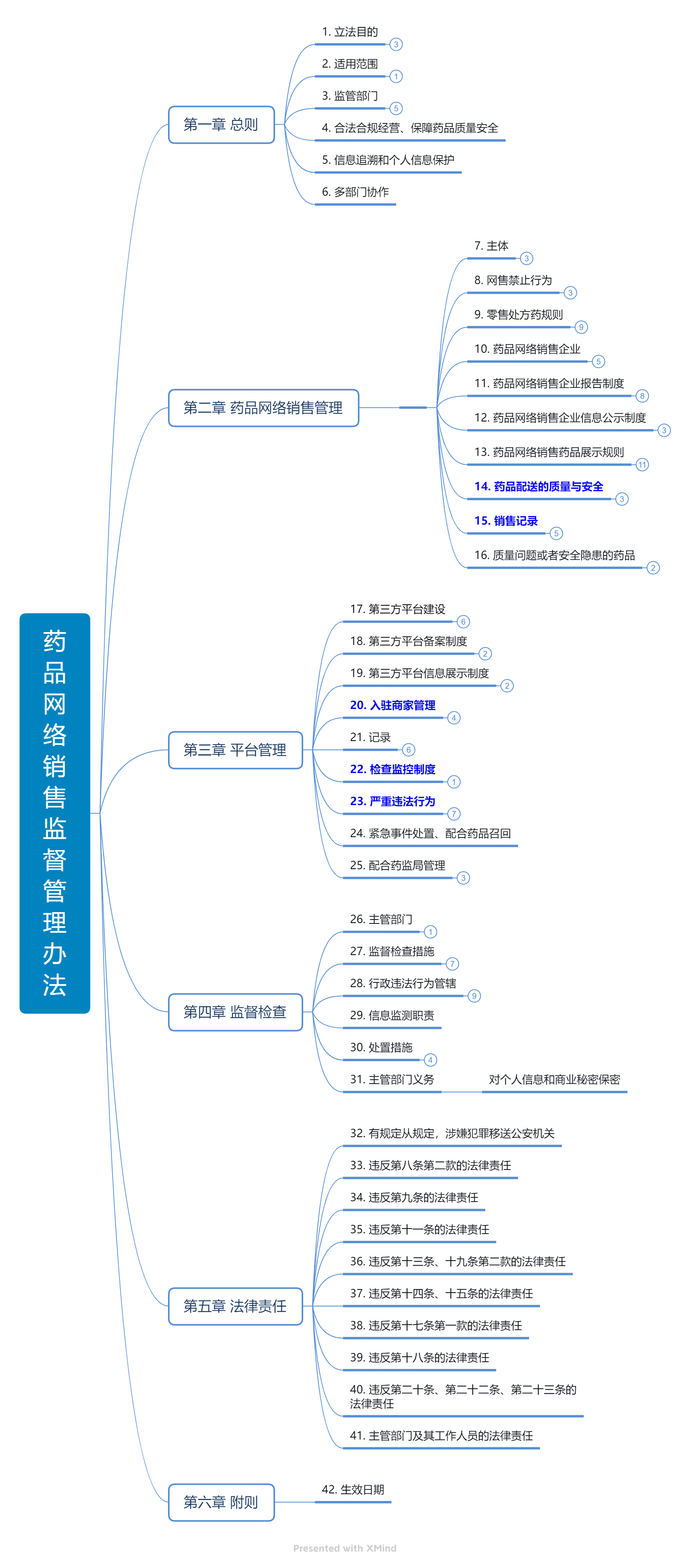
4. 2022年9月1日,国家市场监督管理总局发布《药品网络销售监督管理办法》
历经四年,三次公开征求意见,2022年9月1日,国家市场监督管理总局正式发布《药品网络销售监督管理办法》(国家市场监督管理总局令第58号,“《办法》”),《办法》自2022年12月1日起施行。
《办法》共6章42条,对药品网络销售管理、平台责任履行、监督检查措施及法律责任作出了规定,对平台责任、处方药信息展示、处方管理等热门问题也已一锤定音。根据《办法》,“药品网络零售企业在处方药销售主页面、首页面不得直接公开展示处方药包装、标签等信息。通过处方审核前,不得展示说明书等信息,不得提供处方药购买的相关服务。”
处方药网络展示遭遇困境,“先药后医”模式也遭遇《办法》、《互联网诊疗监管细则(试行)》的双重否定,医药电商处方药的销售模式将面临变革。
点击可查看大图
(二)
医疗器械
1. 2022年3月10日,国家市场监督管理总局发布新修订《医疗器械经营监督管理办法》《医疗器械生产监督管理办法》
2021年,《医疗器械监督管理条例》全面修订,对医疗器械研发、注册、生产、经营管理制度进行全面改革。
国家市场监督管理总局于2022年3月10日发布了《医疗器械经营监督管理办法》(国家市场监督管理总局令第54号)和《医疗器械生产监督管理办法》(国家市场监督管理总局令第53号),以上两办法于2022年5月1日起生效。两办法旨在落实《医疗器械监督管理条例》所确立的医疗器械生产、经营管理制度,细化医疗器械生产和经营环节(批发、零售)的监管要求,落实企业主体责任。
(三)
互联网医疗
1. 2022年3月1日,《医师法》生效
2021年全国人大常委会通过《医师法》,取代了1999年颁布实施的《执业医师法》。《医师法》于2022年3月1日生效实施。本次修订,在法律层面明确放开医师多点执业,明确超说明书用药的适用情形及程序要求,并与《民法典》《基本医疗卫生与健康促进法》保持一致,并确立了过度医疗的行政罚则。
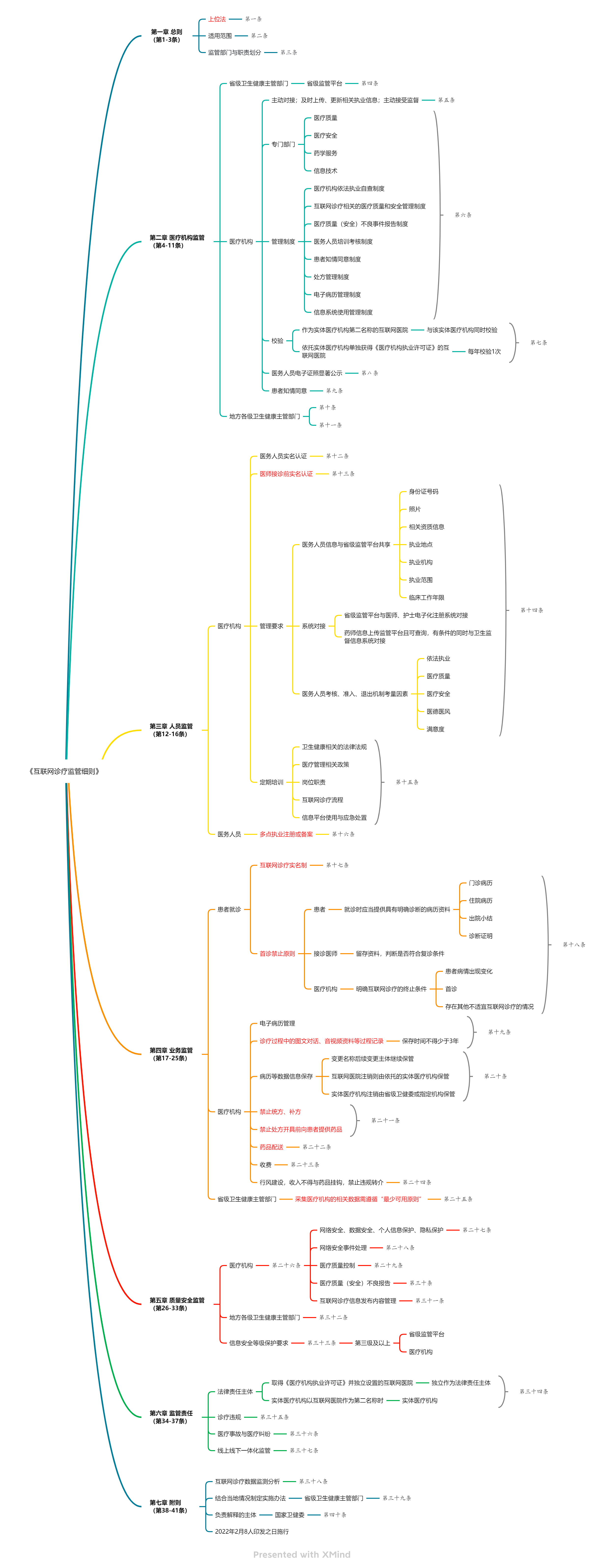
2. 2022年2月8日,国家卫生健康委员会和国家中医药管理局联合发布《互联网诊疗监管细则(试行)》
《互联网诊疗监管细则(试行)》系继2018年我国发布《互联网诊疗管理办法(试行)》等三部互联网诊疗相关规则后第四部关于互联网诊疗的重要法律规章。
过去三年,受新冠疫情影响,互联网诊疗行业爆发性发展,但也出现“先药后方”、人工智能替代医师接诊等饱受争议的问题。
《互联网诊疗监管细则(试行)》总结实践出现的问题,对互联网诊疗的关键流程和争议的做法提出了明确的监管要求,包括“严禁使用人工智能等自动生成处方”、“严禁在处方开具前,向患者提供药品”等,为互联网诊疗进一步发展提供合规指引。
点击可查看大图
(四)
生物安全
1. 2022年3月21日,科学技术部发布《人类遗传资源管理条例实施细则(征求意见稿)》
2019年《人类遗传资源管理条例》(“《条例》”)对整个医药行业研发实践产生不小的振动。随着《条例》的实施产生了较多的实践问题,行业一直期待更为细化的细则规定出台。2022年3月21日,科学技术部发布《人类遗传资源管理条例实施细则(征求意见稿)》,具体内容层面吸收了此前已发布的人类遗传资源行政许可和备案的指南相关规定、行政处罚的程序性规定。同时,在已有规则的基础上,《人类遗传资源管理条例实施细则(征求意见稿)》也有不少突破和亮点,比如人类遗传资源信息的定义调整、外方单位的认定标准、采集审批范围的限缩、执法权限下放等,如其正式施行预计将对行业实践产生不小影响。
二、司法与执法篇
(一)
反腐败
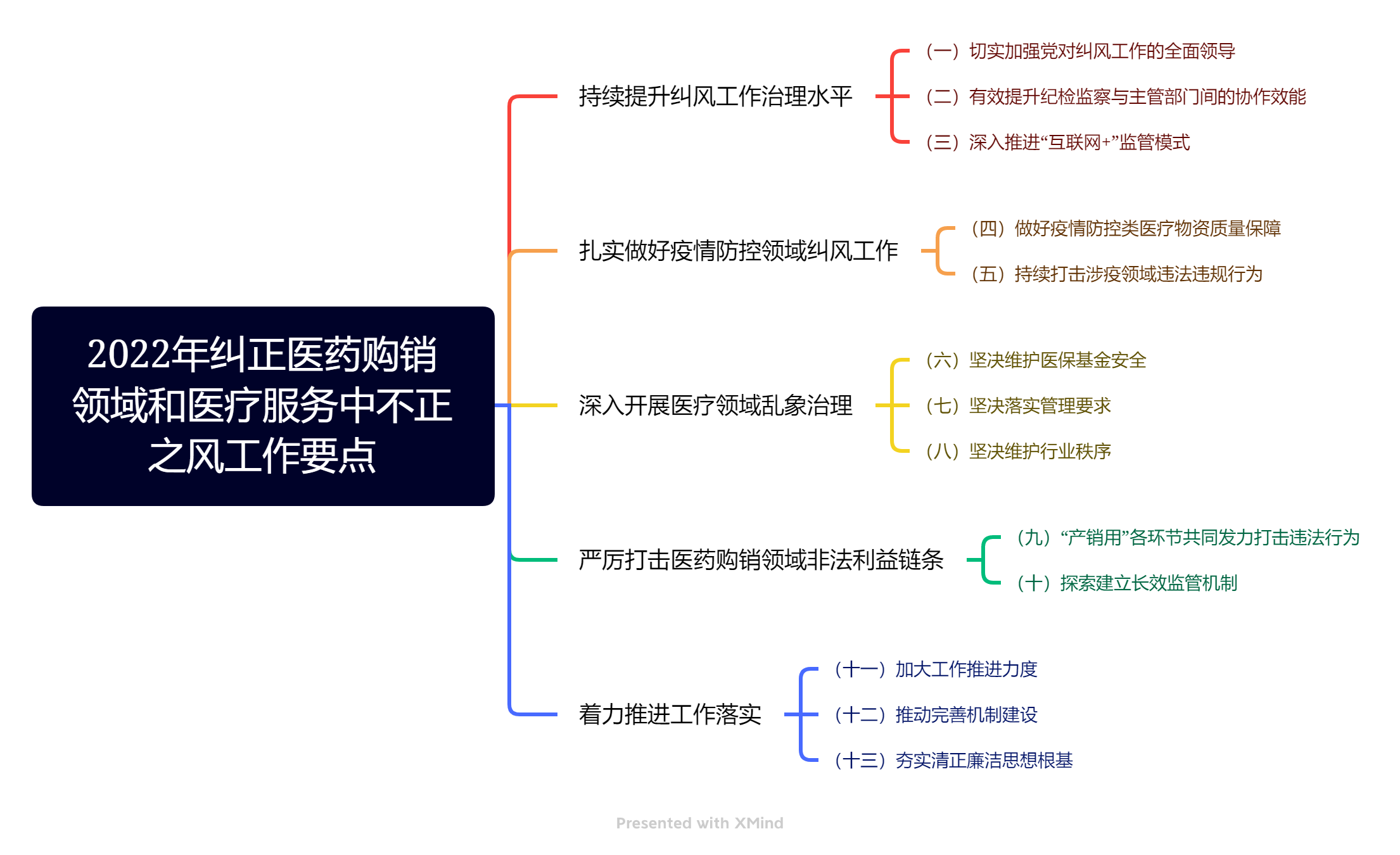
1. 2022年5月9日,九部委发布《2022年纠正医药购销领域和医疗服务中不正之风工作要点》
国家卫健委等九部门每年发布纠正医药购销领域和医疗服务机构不正之风工作要点通知,反贿赂一直是工作重点,今年亦不例外。《2022年纠正医药购销领域和医疗服务中不正之风工作要点》(“《工作要点》”)再次明确“严厉打击医药购销领域非法利益链条”,并重点聚焦“医药企业使用票据套取资金,虚构业务事项套取资金,利用医药推广公司空设、虚设活动等违规套取资金,账簿设置不规范,将套取资金用于‘带金销售’、商业贿赂的违法违规行为……严格限制医疗机构备案采购、议价采购适用情形,规范采购行为,严禁公立医疗机构违规线下采购,防范医疗机构与医药企业合谋提高挂网价格”。
点击可查看大图
《工作要点》发布后,各地启动商业贿赂专项整治行动,重点查处的活动包括医药企业在流通环节使用票据、虚构业务事项以及利用医药推广公司空设、虚设活动等违规套取资金,将套取资金用于商业贿赂的违法违规活动。
8月24日,中纪委再发反腐文章《三堂会审 | 花式借贷难掩受贿之实》,报道周伟平受贿案件。周伟平曾任湖南省资兴市市立医院院长、郴州市中医医院院长、郴州市精神病医院院长等职,2006年至2021年,周伟平担任郴州市中医医院院长、郴州市精神病医院院长期间,利用其职务上的便利,为他人谋取利益,收受他人所送财物共计282万余元。周伟平在担任市中医医院院长期间,收受他人贿赂,未经会议集体研究决定,擅自决定将市中医医院陀螺刀肿瘤治疗中心运营成本从营业收入的40%上调至营业收入的48%,造成128万余元国家经济损失。最终,周伟平被判犯受贿罪、国有事业单位人员滥用职权罪。
在医疗系统反腐执法中,必然牵扯大量药品、医疗器械企业的腐败案件。如今,整个医药医疗体系反腐执法已经形成较为顺畅的合作机制,通过该等合作机制,在医疗系统反腐执法过程中所发现的企业腐败问题,将会移送至有关部门进行查处。
2. 行贿受贿一起查,监察委一并立案调查行贿案件
2021年9月,中央纪委国家监委与中央组织部、中央统战部、中央政法委、最高人民法院、最高人民检察院联合发布《关于进一步推进受贿行贿一起查的意见》(“《意见》”),进一步推进受贿行贿一起查。今年5月份,国家监察委员会、最高人民检察院首次联合发布5起行贿犯罪典型案例,其中即包含一起医药行业行贿案件。
该案中,被告人高某某为长期在某医院销售“大输液”产品并增加销量,谋取不正当竞争优势,根据时任该医院院长化某(已判决)的要求,以交付“大输液”利润的方式向化某行贿,先后43次给予化某共计615.9万元;为得到时任该医院药品科科长张某某(已判决)的帮助,先后13次给予张某某人民币共计6万元。2019年7月15日,河南省南召县监察委员会对高某某涉嫌严重违法问题立案调查,8月22日对高某某以涉嫌行贿罪移送南召县人民检察院审查起诉,10月8日南召县人民检察院对高某某以涉嫌行贿罪向南召县人民法院提起公诉,12月16日南召县人民法院以行贿罪判处高某某有期徒刑五年,并处罚金人民币二十万元。一审判决后,被告人高某某未上诉,判决已生效。
本案系“行贿受贿案件一起查”的典型案件,监察委在调查受贿案件过程中,可对行贿案件一并立案调查,后移送检察院审查起诉。
3. 典型行政处罚案例,当事人被罚98万
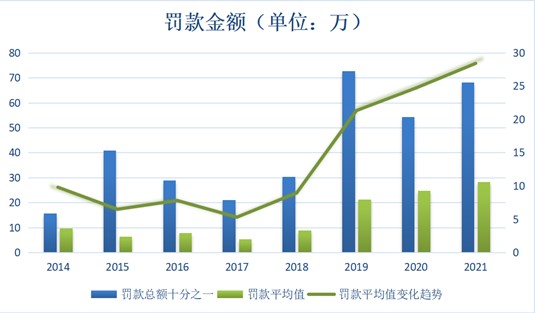
2022年3月17日,上海市市场监督管理局作出行政处罚决定,因某医疗影像公司上海分公司为开拓市场,获取竞争优势,并维护长期合作关系,向相关医院放射科赠送高档酒水,金额共计人民币15258元,构成不正当竞争行为,无违法所得,被处以罚款98万元的行政处罚。本案当事人未陈述、申辩和举行听证的要求。根据《反不正当竞争法》第十九条,罚款金额在10万元至300万元之间。有统计报告显示,适用新反法的案件中,商业贿赂行政处罚罚款数额平均在30万元以下,而本案罚款数额显著高于平均水平。尤其相较于本案的行贿金额,本案罚款数额是比较高的。新《反不正当竞争法》实施之后,商业贿赂案件罚款数额已有显著提高,本案又将罚款数额推向新高。
点击可查看大图
(二)
药品安全
1. 2022年3月3日,两高发布《关于办理危害药品安全刑事案件适用法律若干问题的解释》
2022年3月3日,最高人民法院、最高人民检察院发布《关于办理危害药品安全刑事案件适用法律若干问题的解释》(“《解释》”),《解释》于3月6日施行。《解释》顺应《刑法修正案(十一)》,就“生产、销售、提供假药罪”“生产、销售、提供劣药罪”“妨害药品管理罪”等药品安全相关刑事罪名涉及的认定标准作进一步明确。《解释》共计二十一条,内容与《药品管理法》衔接,确立“假药”“劣药”的认定依据、妨害药品管理罪的定罪量刑标准,界定进口未注册药品的行为性质,明确骗保及倒卖利用骗保购买的药品的行为性质等。
2. 2022年4月28日,最高院发布10个药品安全典型案例
配合《解释》的发布,4月28日,最高人民法院发布10个涉药品安全的刑事、行政和民事典型案例,指导2022年涉药品审判工作,案例基本信息如下:
-
案例一:牛某某等生产、销售假药案——用针管灌装生理盐水假冒九价人乳头瘤病毒疫苗销售
-
案例二:高某等生产、销售假药案——“黑作坊”将中药和西药混合研磨成粉冒充纯中药销售
-
案例三:北京某肿瘤药品有限公司销售假药案——药品公司通过非法渠道采购并销售假药
-
案例四:某药业有限公司诉广东省原食品药品监督管理局、原国家食品药品监督管理总局行政处罚及行政复议案——监督支持行政机关依法查处生产、销售劣药行为
-
案例五:某药业有限公司诉山东省济南市原食品药品监督管理局、山东省原食品药品监督管理局行政处罚及行政复议案——监督支持行政机关依法查处生产劣药行为
-
案例六:秦某诉甘肃省陇西县原食品药品监督管理局行政处罚案——监督支持行政机关依法查处生产、销售假药行为
-
案例七:某药店诉重庆市原食品药品监督管理局万州区分局行政处罚案——监督支持行政机关依法查处出租药品经营许可证及销售假药行为
-
案例八:钟某某、杜某甲、杜某乙与某药房、袁某某生命权纠纷案——销售中药饮片应告知煎服用法及注意事项
-
案例九:许某与某药房买卖合同纠纷案——消毒产品标示治疗功能误导消费者购买构成欺诈
-
案例十:杨某某诉某药房合同纠纷案——销售未注明产品批号的药品应承担赔偿责任
3. 2022年6月24日,国务院办公厅发布《关于成立集中打击整治危害药品安全违法犯罪工作领导小组的通知》
为进一步加强对药品安全工作的组织领导和统筹协调,深入开展集中打击整治危害药品安全违法犯罪专项行动,国务院决定成立集中打击整治危害药品安全违法犯罪工作领导小组。工作领导小组的主要职责为:统筹协调集中打击整治危害药品安全违法犯罪工作,研究解决药品安全工作中的重大问题,部署推进重点工作;督促检查药品安全有关法律法规和重大政策措施落实情况;督办危害药品安全违法犯罪重大案件处置工作;总结、推广药品安全工作经验等。该通知还要求,县级以上地方各级人民政府要建立本地区集中打击整治危害药品安全违法犯罪工作机制,统筹推进本地区打击整治危害药品安全违法犯罪工作。通知发布后,各级地方政府,纷纷成立本地区工作小组,加强药品安全执法。
(三)
医保局相关执法
1. 2022年医疗保障基金飞行检查工作继续开展,重点检查“伪造医学相关资料、虚构医药服务项目等方式骗取医保基金”等行为
2022年1月29日,国家医保局公布一起药企工作人员涉嫌篡改肿瘤患者基因检测结果骗取医保基金的案件,该案件去年由医保、公安、卫生健康、市场监管等部门联合调查。该起案件使骗保案件成为舆论关注重点。
随后,在国家医保局、财政部、国家卫健委、国家中医药局联合发布的《2022年度医疗保障基金飞行检查工作方案》中,通过伪造医学相关资料骗取医保基金,也成为重点检查事项。此次工作方案明确检查对象为全国范围内定点医疗机构、县区级医保经办机构,视情况可延伸检查相关机构和参保人。检查范围包括定点医疗机构血液透析、高值医用耗材(骨科、心内科)等领域纳入医疗保障基金支付范围的医疗服务行为和医疗费用(包括本地接收跨省异地就医人员结算费用),医保经办机构服务协议履行及费用审核与结算支付,以及通过伪造医学相关资料、虚构医药服务项目等方式骗取医保基金行为等。
点击可查看大图
2. 招采信用评价失信名单定期更新
自2020年招采信用评价制度建立以来,国家医疗保障局已经向全社会公开发布了3次价格招采信用评价“严重”和“特别严重”失信评定结果,业内俗称“招采失信名单”。作为配套措施,2020年9月17日,国家医疗保障局与最高人民法院签署《关于开展医药领域商业贿赂案件信息交流共享的合作备忘录》,建立“医药领域商业贿赂案件定期通报制度”。
第一次“招采失信名单”发布时间为2021年9月27日,涉及5家企业,其中3家涉及商业贿赂;第二次“招采失信名单”发布时间为2022年6月10日,公布的6家企业均涉及商业贿赂;第三次“招采失信名单”发布时间为2022年8月4日,公布的2家企业均涉及商业贿赂,即已经公示的招采失信名单中,因商业贿赂案件而涉失信的企业占比超过85%。
企业一旦构成“严重失信”,则该企业“涉案药品或医用耗材”挂网、投标或配送资格将被限制或中止;一旦构成“特别严重失信”,则该企业“全部药品和医用耗材”挂网、投标或配送资格将被限制或中止,相应后果于企业而言非常严重。
招采信用评价制度中同时配套失信企业信用恢复制度,企业仍有机会通过采取信用恢复措施,恢复企业信用,消除不利后果。
3. 医保局主导虚抬药价违法调查
2022年8月9日,国家医疗保障局发布了《关于XX制药等3家企业虚增原料药价格、虚抬药价套取资金有关情况的通报》(“《通报》”),通报了对3家企业药品虚高定价、套取资金进行专项调查的相关情况。
这3家企业按要求在全国范围内对涉案的注射用头孢硫脒等87种药品进行价格整改,剔除现行价格中用于实施贿赂等虚高部分,平均降幅50%以上,部分品规被停止采购。广东省责令这3家企业以及关联的其他企业全面整改营销模式,停止相关违规操作。此外,对其中涉嫌违纪、违法、犯罪的人员,有关部门正在依纪依法查处。
归纳总结《通报》要点如下:第一,调查的主导机构系国家医疗保障局;第二,调查的核心违法行为是“药品虚高定价、套取资金”;第三,调查的对象覆盖三家药品生产企业及其50余家药品代理商;第四,套取资金的核心方式是虚增原料药成本,通过原料药经销商套取原料药虚增的成本差额,套取后的资金转移至下游代理商,由下游代理商利用套取资金行贿。
(四)
核酸检测相关执法
为有效控制新冠疫情,核酸检测的需求日益常态化。基于利欲熏心或超负检测而出现遗漏检测的核酸检测机构不仅将面临吊销医疗机构许可证等严苛的行政处罚,如果情节严重、造成了疫情传播或者具有传播严重危险的,相关责任人员还会因涉嫌妨害传染病防治罪被追究刑事责任。
1. 北京朴石医学检验实验室有限公司,因核酸检测原始检测数据明显少于样本检测数量,被吊销《医疗机构执业许可证》
2022年5月15日,北京市房山区卫生健康委员会作出京房卫医罚﹝2022﹞058号行政处罚决定书,吊销北京朴石医学检验实验室有限公司《医疗机构执业许可证》,该公司的违法事实为:“2022年5月14日,监督员发现位于北京市房山区广阳大街9号1幢3层315-323的北京朴石医学检验实验室有限公司原始检测数据明显少于样本检测数量。”
监管部门依据的法律为《突发公共卫生事件应急条例(2011修订)》第二十一条和第五十条第(一)项。第二十一条:“任何单位和个人对突发事件,不得隐瞒、缓报、谎报或者授意他人隐瞒、缓报、谎报。”第五十条第(一)项:“医疗卫生机构有下列行为之一的,由卫生行政主管部门责令改正、通报批评、给予警告;情节严重的,吊销《医疗机构执业许可证》;对主要负责人、负有责任的主管人员和其他直接责任人员依法给予降级或者撤职的纪律处分;造成传染病传播、流行或者对社会公众健康造成其他严重危害后果,构成犯罪的,依法追究刑事责任:(一)未依照本条例的规定履行报告职责,隐瞒、缓报或者谎报的;”
从5月14日调查发现违法事实,5月15日卫健委即作出吊销《医疗机构执业许可证》的行政处罚,可见监管机构对于核酸检测不如实依规开展核酸检测行为的执法态度十分严厉。
在本案中,根据房山区人民检察院发布通报,2022年6月6日检察机关经审查以涉嫌妨害传染病防治罪依法对周某某、武某某等7人作出批准逮捕决定。
2. 北京金准医学检验实验室有限公司,因违规对多管样本进行3管混管检测,被吊销《医疗机构执业许可证》
2022年5月27日,北京市海淀区卫生健康委员会对北京金准医学检验实验室有限公司作出京海卫医罚〔2022〕29ZJ01号行政处罚决定书,吊销北京金准医学检验实验室有限公司的《医疗机构执业许可证》,该公司的违法事实为:“该单位于2022年4月至5月在北京市区域化新冠病毒核酸检测过程中,未按照政府要求对10混1采样样本单管单检,擅自使用2管或3管混成1管检测,不服从突发事件应急处理指挥部的统一指挥,且情节严重。”
监管部门依据的法律为《突发公共卫生事件应急条例(2011修订)》第五十条第(五)项:“医疗卫生机构有下列行为之一的,由卫生行政主管部门责令改正、通报批评、给予警告;情节严重的,吊销《医疗机构执业许可证》;对主要负责人、负有责任的主管人员和其他直接责任人员依法给予降级或者撤职的纪律处分;造成传染病传播、流行或者对社会公众健康造成其他严重危害后果,构成犯罪的,依法追究刑事责任:……(五)拒不服从突发事件应急处理指挥部调度的。”
同样,该公司相关人员亦被以涉嫌妨害传染病防治罪逮捕。
(五)
广告执法
药品、医疗器械、化妆品的广告一直以来是执法重点领域。随着互联网销售药品、医疗器械、化妆品的普遍,线上广告也逐渐成为监管重点,尤其是种草、直播带货等新型营销推广形式能否适用于药品、医疗器械、保健食品等产品,行业内讨论热烈。我们分享两个典型案例。
-
2022年9月13日,广州市白云区市场监督管理局作出行政处罚决定,认定广州壮富化妆品有限公司在“天猫”互联网平台设立的“色立方”旗舰店的待售商品中标注有“薇娅推荐”、“李佳琦推荐”,祛斑霜产品封面使用薇娅肖像且标注“当天祛斑”字样的行为构成虚假广告和对非药品广告涉及药品的宣传的行为,对广州壮富化妆品有限公司处以了21万元人民币的罚款。
-
2022年9月22日,北京市丰台区市场监督管理局作出行政处罚决定,因北京麦迪瑟生物医药科技开发有限公司于2011年至2019年11月13日,在其自设网站(www.ydyf.cn)首页上发布内容为“999感冒灵颗粒”‘好朋友 三九感冒灵’”的药品广告未经广告审查机关审批,违反了《中华人民共和国广告法》(2018)第四十六条的规定,决定对北京麦迪瑟生物医药科技开发有限公司处以责令停止发布广告,在相应范围内消除影响,罚款20万元的行政处罚。
-
2022年11月28日,上海市市场监督管理局官网公布了一则行政处罚信息,当事人医疗器械经营企业通过MCN机构招募400名某平台博主发表虚构的医疗器械使用体验笔记,被认定虚假宣传,当事人因此被按照《反不正当竞争法》处以高额罚款。










