研究速递 | 转移性三阴性乳腺癌化疗前给予曲拉西利的潜在免疫机制
编者按
既往一项针对转移性三阴性乳腺癌(TNBC)的随机II期试验结果提示,在吉西他滨联合卡铂(GCb)治疗前短暂给予曲拉西利可以增强T细胞活化,并改善患者总生存期(OS)。近日,一项发表在Breast Cancer Research and Treatment期刊的研究,进一步分析了曲拉西利在转移性TNBC中潜在的免疫机制,研究结果提示,在GCb治疗前短暂给予曲拉西利可能会通过调节免疫细胞亚群的组成和功能来增强抗肿瘤免疫应答。曲拉西利通过将T细胞短暂停滞在G1期,避免化疗造成的T细胞损伤,加强T细胞活化,进而增强抗肿瘤免疫功能。
研究背景
TNBC是乳腺癌的一种亚型,与其他乳腺癌亚型相比,具有更高的侵袭性、转移能力,预后较差。由于缺乏激素受体(HR)和人表皮生长因子受体2(HER2)表达,TNBC对内分泌治疗和靶向治疗均不敏感,其系统治疗方案也少于其他亚型乳腺癌。TNBC的特征是基因组不稳定性更高,有助于增强免疫原性和化学敏感性。因此,目前针对TNBC,特别是局部晚期或转移性TNBC,主要的系统治疗方式仍是细胞毒性药物治疗,但化疗产生的副作用会影响患者的生活质量。
曲拉西利是一种具有新型化学结构的CDK4/6抑制剂,与其他CDK4/6抑制剂不同的是,它通过将造血干细胞和祖细胞短暂的停滞在对化疗不敏感的G1期,减少化疗对细胞造成的损伤,降低化疗诱导的骨髓抑制的发生率,从而改善患者生活质量。
既往体内体外实验提示,曲拉西利可通过保护淋巴免疫细胞改变肿瘤的免疫微环境,并起到抗肿瘤作用。具体来说,曲拉西利可以通过改变肿瘤组织T细胞亚群比例和外周血T细胞的数量,来抑制调节性T细胞(Tregs)的免疫抑制功能,增强CD8+T细胞的分化,进而达到增强抗肿瘤免疫应答的目的。
一项随机II期试验(NCT02978716)研究了曲拉西利治疗转移性TNBC患者的疗效与安全性。试验结果提示,在化疗前使用曲拉西利,可上调患者免疫相关基因表达、增强T细胞活化,并改善OS(中位OS分别为12.6个月和19.8个月)。然而,曲拉西利在转移性TNBC中的相关免疫机制目前尚不完全清楚。
本研究中,研究者基于上述试验,评估了患者外周血和肿瘤样本中的免疫细胞亚群,并通过分子分析技术来进一步研究曲拉西利在转移性TNBC中潜在的免疫机制。
研究设计
该试验纳入既往接受≤2个化疗方案的局部晚期或转移性TNBC患者(年龄≥18岁)。试验患者被随机分配到三组中(患者比例为1:1:1),详细分组可见表1。
表1 患者分组说明

本研究探索性的分析了试验的次要终点(疗效和生存结局),包括客观缓解率、无进展生存期(PFS)和OS;评估了肿瘤样本的基因表达差异、免疫细胞群的组成和肿瘤炎症指数(TIS)评分;通过流式细胞术分析治疗前(第一周期治疗的第一天,C1D1)和治疗期间(第三周期治疗的第一天,C3D1)外周血的免疫细胞群及其功能。
研究结果
截至2020年7月17日,组1共纳入34名患者,中位随访时间为8.4个月;组2共纳入33名患者,中位随访时间为14.0个月;组3共纳入35名患者,中位随访时间为15.3个月。
在GCb治疗前接受曲拉西利的68名患者(组2+组3)中,58名患者有肿瘤反应性相关数据,其中27名患者(46.6%)应答。
曲拉西利通过调节外周血免疫细胞群组成提高抗肿瘤免疫功能
GCb前接受曲拉西利的患者(组2+组3)经过两个周期治疗后,外周血T细胞、CD8+T细胞和髓源性抑制细胞(MDSCs)数目减少;而单独接受GCb方案治疗的患者没有观察到细胞数目的显著变化(图1a)。在GCb前接受曲拉西利患者的外周血中,产生细胞因子的CD4+和CD8+T细胞比例显著增加(图1b)。
接受曲拉西利的患者,虽然外周血T细胞和CD8+T细胞数量减少,但抑制免疫的MDSCs数目减少更多;相对来说,则使具有抗肿瘤作用的活化T细胞的比例增加。
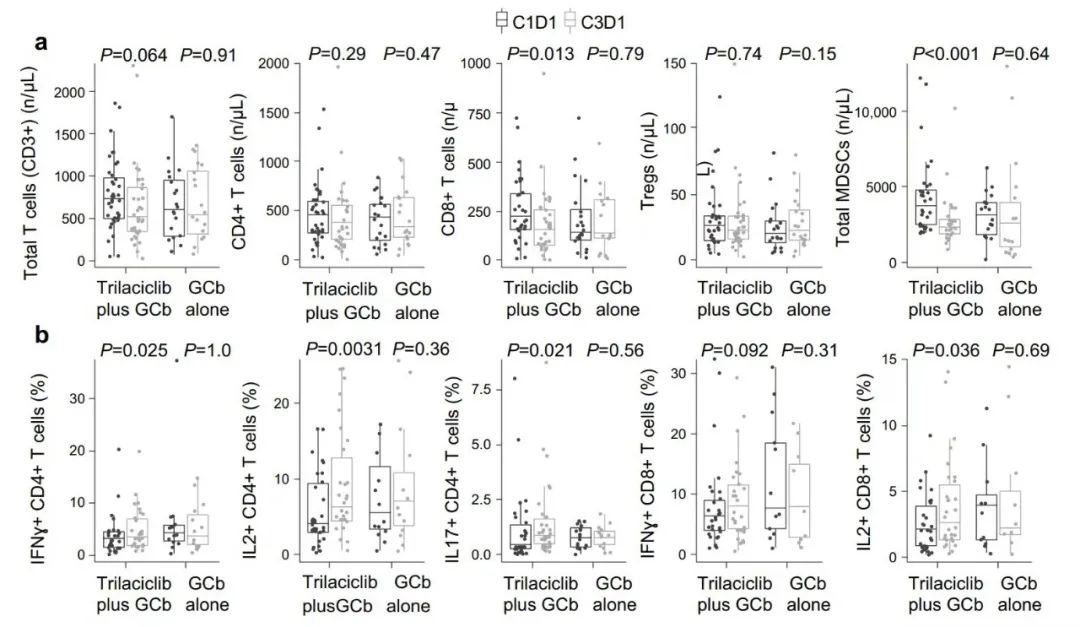
图1 不同治疗方案的T细胞亚群及效应功能变化
曲拉西利无应答者,外周血免疫细胞群及功能降低
化疗前接受曲拉西利患者(组2+组3)共68名,其中58名患者有肿瘤反应性相关数据,对58名患者是否产生曲拉西利应答进行亚组分析。两个周期治疗后,曲拉西利应答者T细胞数量维持不变,无应答者T细胞、CD4+T细胞和CD8+T细胞数目减少。无论是否产生应答,曲拉西利均可使起到免疫抑制功能的MDSCs数目减少(图 2)。
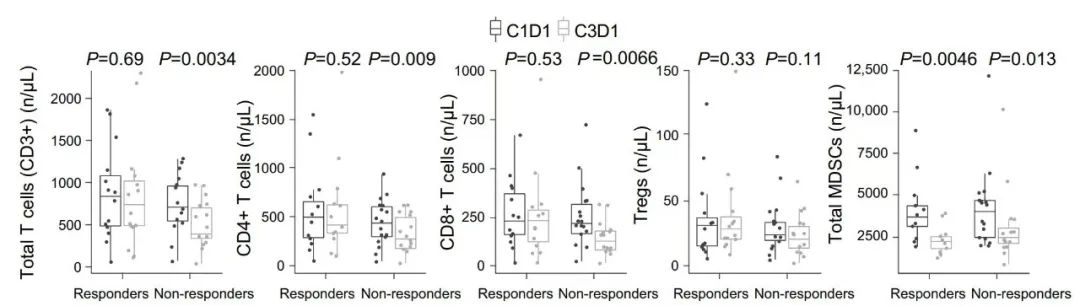
图2 曲拉西利无应答者与曲拉西利应答者的免疫细胞亚群变化
在对免疫细胞功能的检测中,起到抗肿瘤活性的γ干扰素+(INFγ+)CD4+T细胞和白细胞介素17+(IL-17+)CD4+T细胞在曲拉西利应答者中显著增加,其他无明显变化,提示曲拉西利应答患者抗肿瘤免疫功能无明显变化或改善;细胞表达人类白细胞DR抗原(HLA-DR)是T细胞活化的标志,而在曲拉西利无应答者中,表达HLA-DR的CD4+和CD8+T细胞显著减少,其他无明显变化,提示无应答患者中功能维持不变或降低(图 3)。
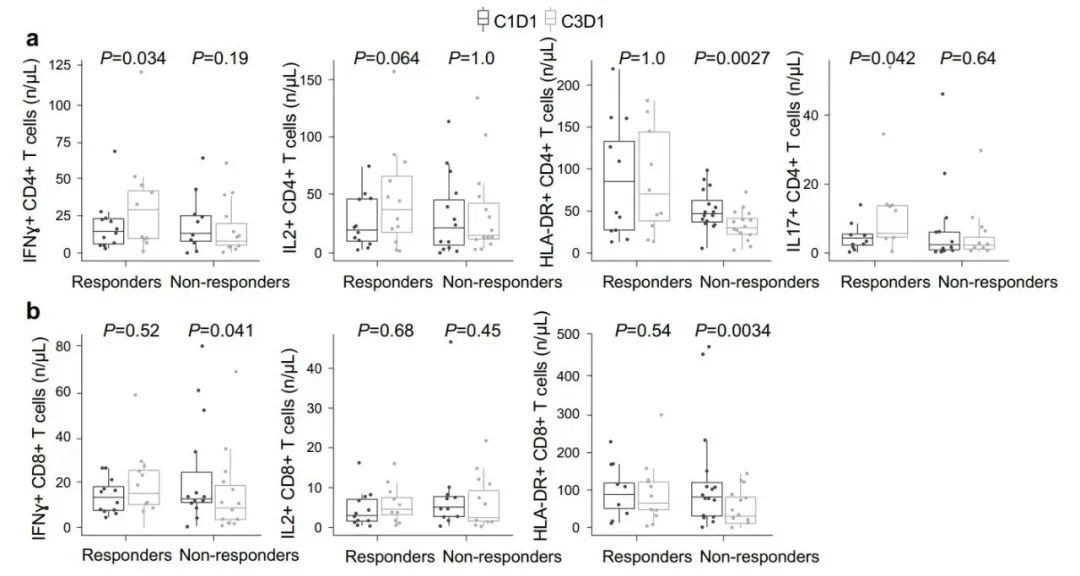
图3 曲拉西利无应答者与曲拉西利应答者的T细胞功能变化
曲拉西利应答者,基线肿瘤样本免疫相关基因及信号通路上调
基线时曲拉西利应答者(n=15)和无应答者(n=17)肿瘤样本共有69个差异表达基因(adj. P<0.05;图4)。与曲拉西利无应答者相比,曲拉西利应答者共有23个基因上调,46个基因下调(表2)。
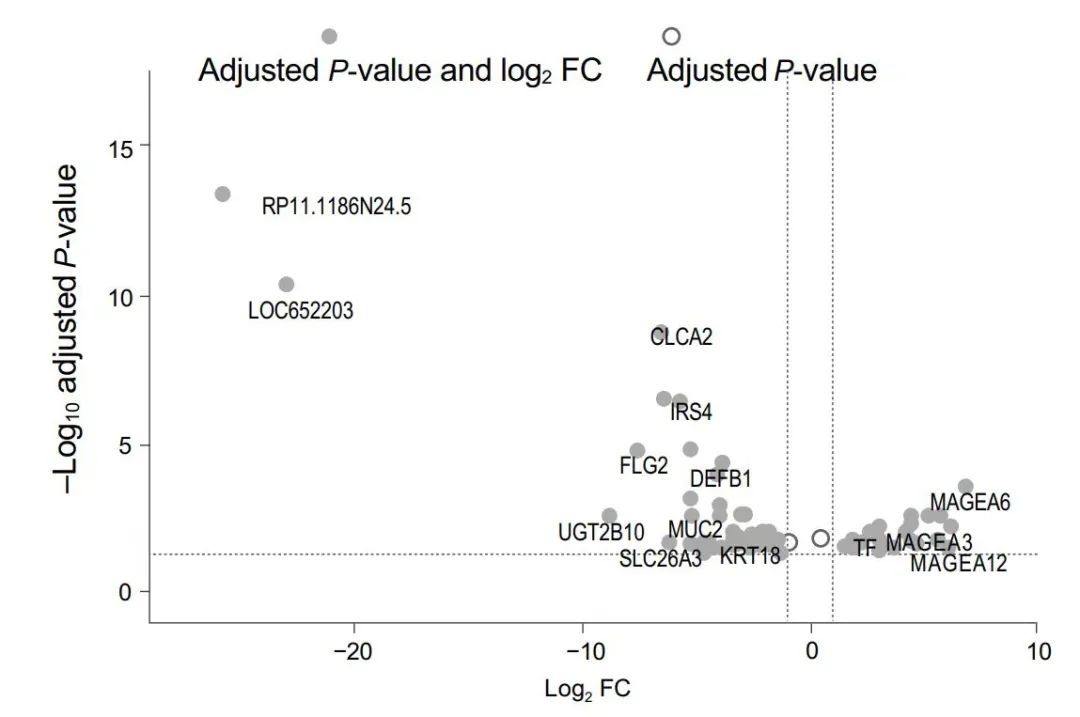
图4 基因表达差异
表2 曲拉西利应答者中差异基因

KEGG富集分析显示,在曲拉西利应答者中与免疫应答产生的相关信号通路(T细胞受体信号通路、抗原加工和呈递、NK细胞介导的细胞毒性、核苷酸结合寡聚化结构域样受体信号通路、Toll样受体信号通路、胞质DNA感受通路、移植物抗宿主疾病和鞘糖脂生物合成)上调(FDR<0.25)。对免疫基因特征的分析显示,与无应答者相比,曲拉西利应答者TIS评分更高(图5)。在曲拉西利应答患者中,T细胞/NK细胞丰度、干扰素(IFN)活性和T细胞耗竭的TIS评分有上升趋势。
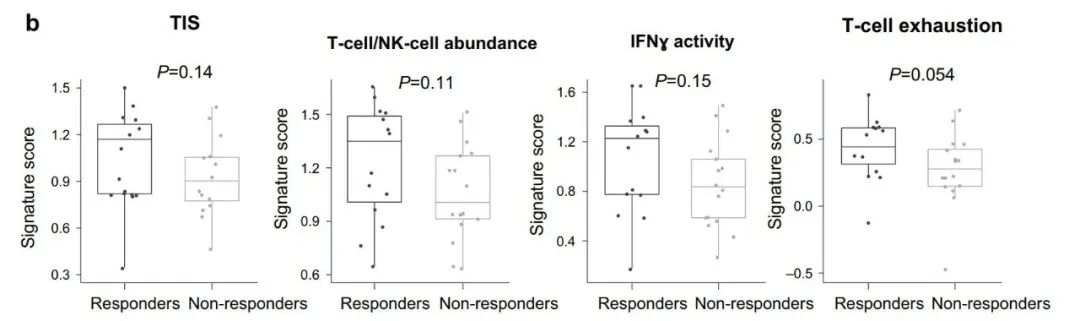
图5 免疫基因特征分析
研究结论
曲拉西利作为高效、选择性、短暂可逆的CDK4/6抑制剂,可使T细胞在G1期短暂停滞,进而降低肿瘤微环境中免疫抑制细胞的比例,增强免疫细胞群的抗肿瘤功能。同时,在GCb治疗前接受曲拉西利治疗的两组患者中,MDSCs数量均减少,表明曲拉西利可减少免疫抑制,从而增强免疫介导的抗肿瘤应答。在含有曲拉西利的治疗方案中,肿瘤样本差异基因表达可能预测曲拉西利应答。
本研究证明在GCb治疗之前短暂给予曲拉西利,可通过调节TNBC免疫细胞亚群的组成和功能来增强抗肿瘤免疫应答。
仅供医疗卫生专业人士阅读
作者:YMT;
审校:骆浩,任冰鑫,颜爱竹,曹嵩;
美编:王贤;
正文图片:改编自原文;
封面图片:UgoMedia;

