珠联璧合,艾拉莫德联用托法替布有效缓解类风湿关节炎与继发性骨质疏松症 | 研究速递
类风湿关节炎(RA)是一种以关节滑膜炎症为主要病理基础的自身免疫病,致残率高。其发病机制尚不明确,基本病理表现为滑膜炎、血管翳形成,并逐渐出现关节软骨和骨破坏,最终导致关节畸形和功能丧失[1]。
艾拉莫德(IGU)是我国自主研发的新型传统合成DMARDs,可调节机体免疫功能,改善病理性免疫状态,并可避免免疫系统异常持续损害关节,抑制骨吸收和关节破坏,目前已在国内获批治疗RA。Janus激酶(JAK)抑制剂是用于治疗RA的新型靶向DMARDs,有研究显示托法替布(TOF)可显著刺激成骨细胞功能并增加骨量。据报道,IGU与甲氨蝶呤、TNF-α抑制剂、托珠单抗等联合治疗具有叠加效应。然而,目前尚不清楚IGU联合TOF治疗是否也有此疗效。
在此背景下,山东大学齐鲁医院风湿科舒强教授等人开展了一项基于胶原诱导关节炎(CIA)模型的动物研究,旨在探讨IGU联合TOF治疗对RA和继发性骨质疏松症的协同效果[2]。该研究近日发表于《Int Immunopharmacol.》(IF 5.6)。
重点一览
IGU联合TOF可有效减轻CIA模型的滑膜炎症。
IGU联合TOF可明显改善CIA模型的骨质疏松症。
IGU联合TOF可显著抑制CIA模型中滑膜组织的细胞焦亡。
研究纳入40只Sprague-Dawley大鼠(6周龄),并将其随机分为五组:(1)正常对照组;(2)CIA+TNF模型组(CIA);(3)TOF治疗组(TOF);(4)IGU治疗组(IGU);(5)IGU+TOF联合治疗组(IGU+TOF)。诱导大鼠患自身免疫性关节炎后,给予大鼠口服IGU 10 mg/kg·d和/或TOF 12 mg/kg·d,治疗6周。对照组大鼠同时给予等量的生理盐水。
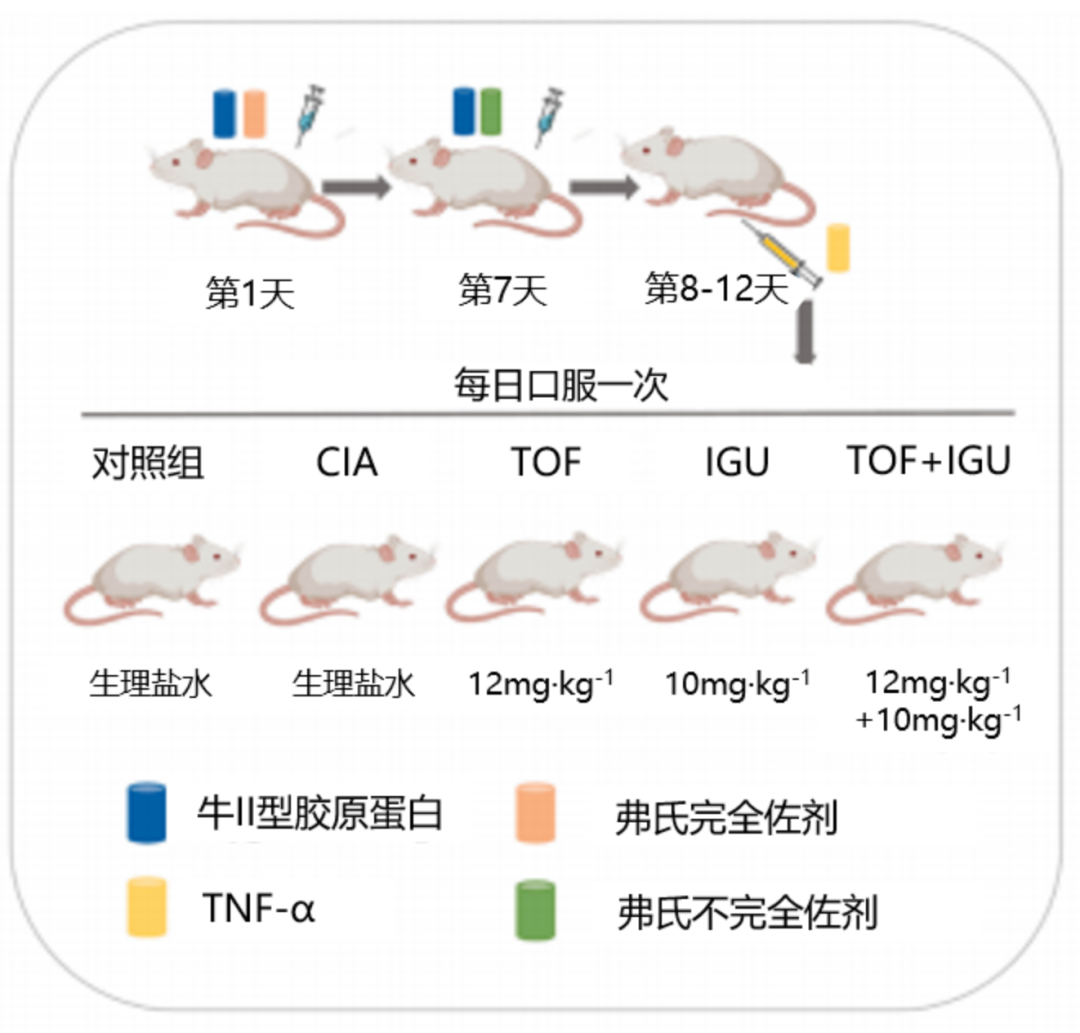
图1 CIA模型建立及治疗方案
采用苏木精-伊红(HE)染色法、免疫组化(IHC)、显微计算机断层扫描(CT)以及酶联免疫吸附测定法(ELISA)等多种方法评估IGU+TOF联合治疗的疗效。
缓解滑膜炎症,减轻病理改变
与对照组相比,CIA模型大鼠的后爪厚度和关节炎评分达到顶峰(P<0.001)。治疗6周后,TOF和IGU+TOF显著缓解了大鼠后爪肿胀(分别为P<0.01和P<0.001,图2)。
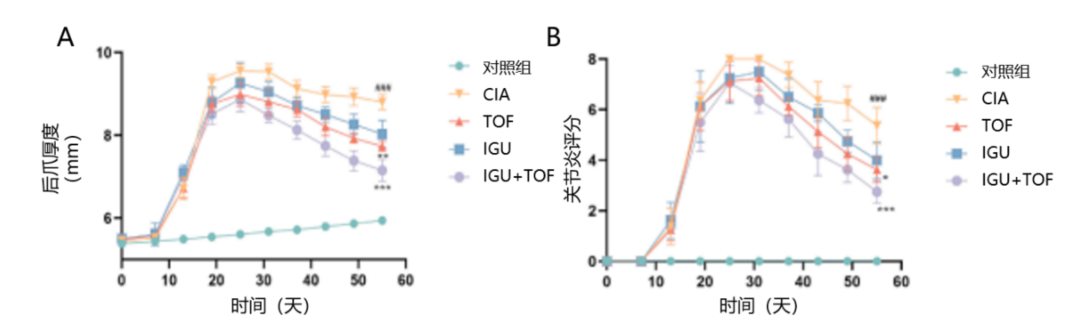
图2 IGU+TOF改善CIA模型的后爪厚度(A)和后爪关节炎评分(B)
与CIA模型相比,*P<0.05,**P<0.01,***P<0.001
HE染色显示,与对照组相比,CIA模型大鼠表现出明显的关节软骨侵蚀、广泛的炎症细胞浸润和明显的滑膜增生,而IGU+TOF有效减轻了大鼠踝关节的病理改变,包括关节软骨的破坏、炎症细胞浸润及血管翳形成。同时,ELISA结果显示,与对照组相比,CIA模型大鼠血浆中白细胞介素(IL)-18、IL-1β和IL-6的水平显著升高(P<0.001)。在治疗6周后,与TOF相比,IGU+TOF显著降低IL-18和IL-6水平(P<0.05);与IGU相比,IGU+TOF也显著降低了IL-1β和IL-6水平(分别为P<0.01和P<0.05,图3)。
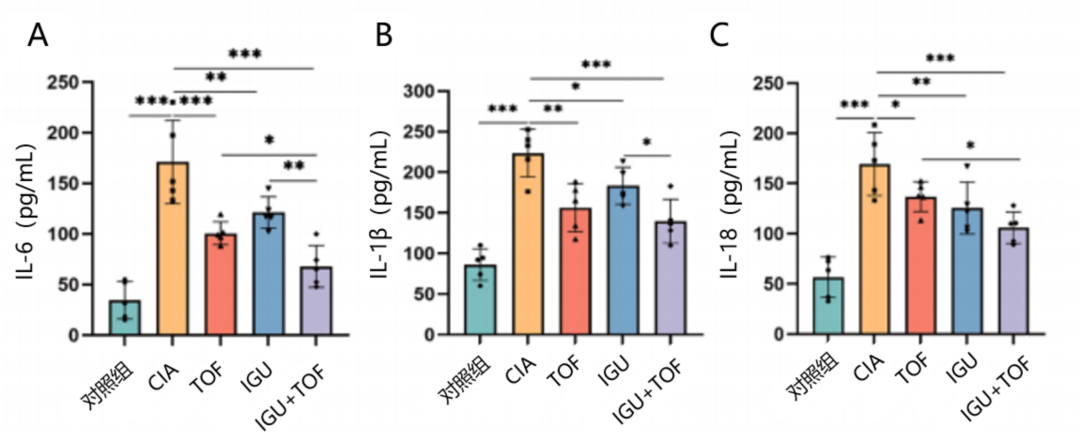
图3 IGU+TOF显著降低IL-6(A)、IL-1β(B)、IL-18(C)水平
与CIA模型相比,*P<0.05,**P<0.01,***P<0.001
减少骨质流失,提高骨转换率
micro-CT显示,与对照组相比,CIA模型大鼠在外源性TNF-α的诱导下表现出明显的骨质流失,包括骨小梁间距增大和骨小梁数量减少,以及严重的骨侵蚀和骨面粗糙。治疗6周后,micro-CT显示,IGU在减少骨质流失和增加骨密度方面比TOF更为有效。IGU+TOF可显著提高骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)和骨体积/组织体积(BV/TV)的比率,并显著降低骨小梁分离度(Tb.Sp)(分别为P<0.001、P<0.001、P<0.01和P<0.05,图4),疗效优于单药治疗。
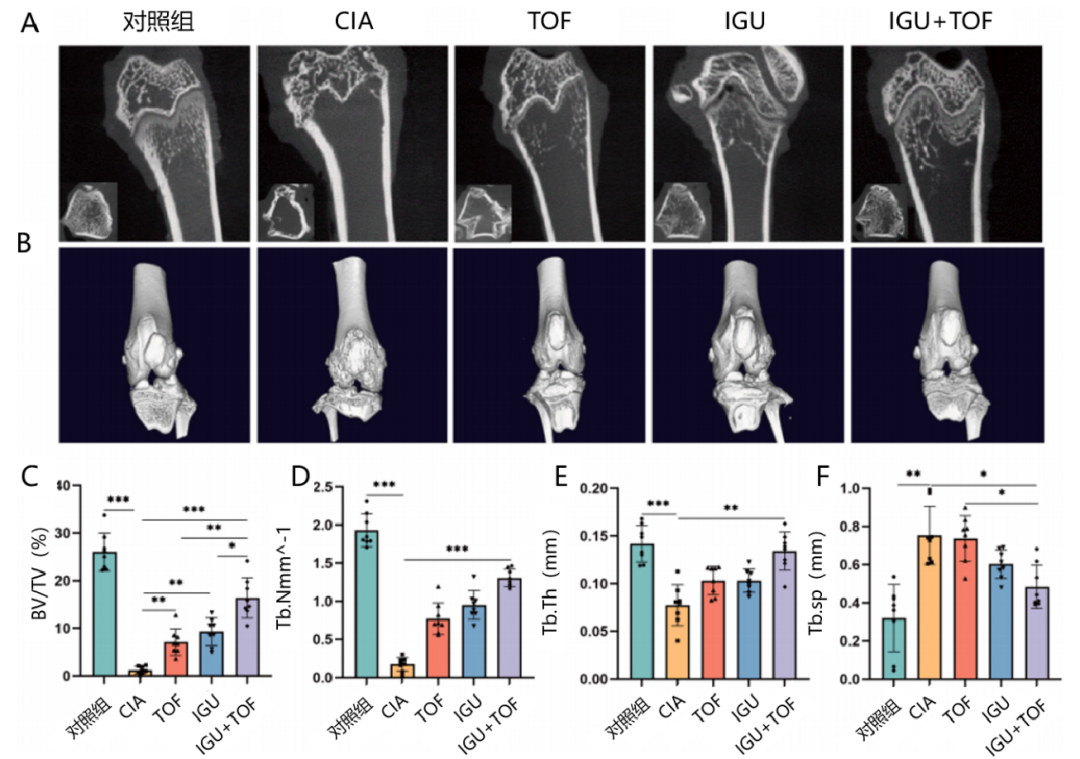
图4 IGU+TOF协同缓解CIA模型继发性骨质流失
(A、B)各组股骨远端micro-CT图像;(C-F)各组股骨远端骨小梁结构参数。与CIA模型相比,*P<0.05,**P<0.01,***P<0.001
此外,研究通过碱性磷酸酶(ALP)和抗酒石酸酸性磷酸酶(TRAP)染色,观察IGU和TOF对成骨细胞和破骨细胞的影响。与对照组相比,CIA模型大鼠骨小梁表面的ALP阳性成骨细胞和TRAP阳性破骨细胞较少,表明其骨转换率减慢。而与CIA模型相比,TOF治疗组显示有大量ALP阳性成骨细胞且几乎没有TRAP阳性破骨细胞,表明TOF增强了成骨细胞的生成。相比之下,IGU治疗组的成骨细胞和破骨细胞数量均有所增加,表明IGU可促进骨转换。研究者推测,IGU+TOF联合治疗可显著增强骨形成能力,提高ALP免疫反应性,增加破骨细胞数量,并提升骨转换率。
抑制细胞焦亡,体内外作用一致
IHC检测显示,与对照组相比,CIA模型大鼠的NOD样受体热蛋白结构域相关蛋白3(NLRP3)、消皮素D(GSDMD)、IL-1β和半胱天冬蛋白酶-1(CASP-1)等细胞焦亡相关蛋白表达水平更高,而TOF+IGU显著减少了滑膜组织中上述细胞焦亡相关蛋白的表达,并且在体外研究中也观察到了一致的作用(图5)。
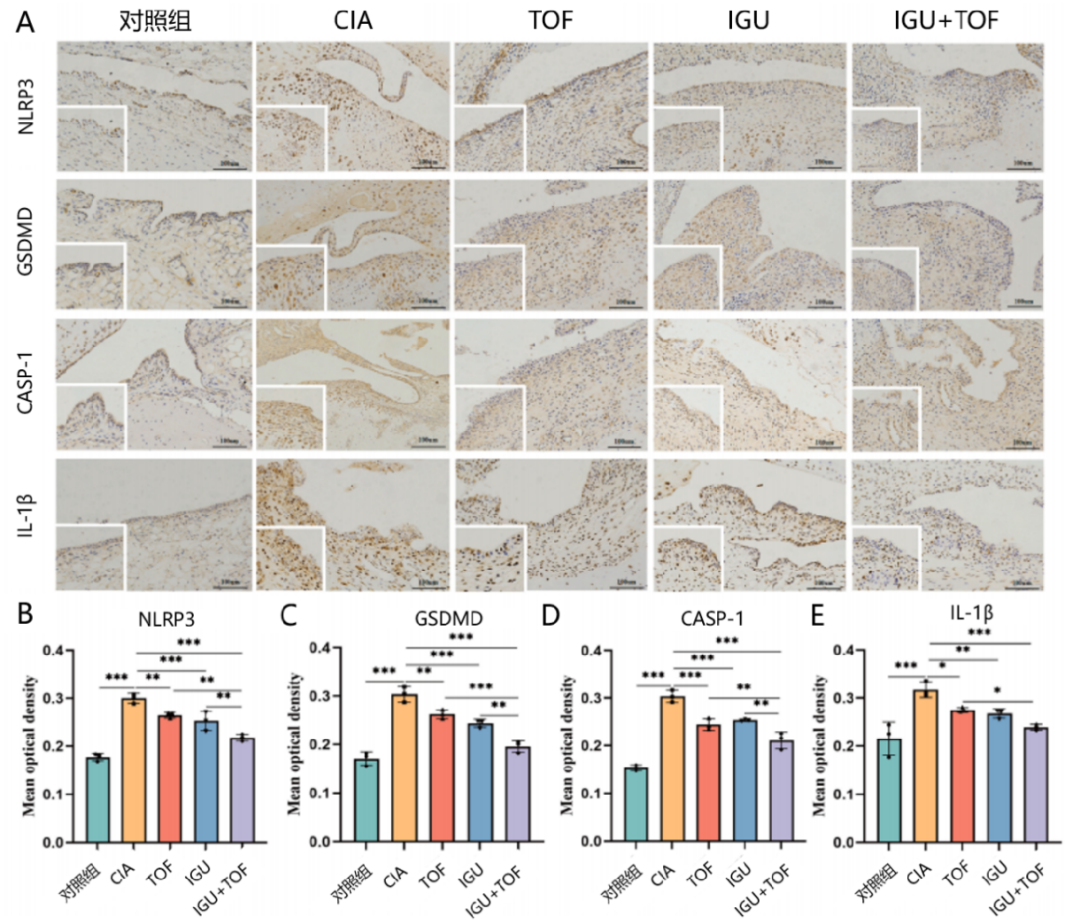
图5 IGU+TOF抑制滑膜组织中细胞焦亡相关蛋白的表达
(A)免疫组化检测中各组滑膜组织中GSDMD、NLRP3、CASP-1和IL-1β蛋白的表达;(B-E)各组GSDMD、NLRP3、CASP-1和IL-1β蛋白表达情况。与CIA模型相比,*P<0.05,**P<0.01,***P<0.001
RA患者体内存在多因素相互作用下导致的免疫异常活跃,损害正常关节组织,诱发组织炎性反应和关节软骨细胞破坏、骨质破坏。及时采用高效治疗方案,是改善关节疼痛、肿胀症状的关键,对于降低畸形、残疾风险尤为关键[3]。
目前,已有多项研究证实IGU联合其他传统合成DMARDs(如甲氨蝶呤)或生物制剂治疗RA的疗效及安全性。Fang Du等人的研究表明,IGU(5 mg/kg/d和20 mg/kg/d)可显著降低CIA模型的关节炎评分,而IGU(10 mg/kg/d)联合甲氨蝶呤治疗几乎可以完全抑制关节炎进展[4]。与IGU联合甲氨蝶呤的疗效相似,本研究证实IGU(10 mg/kg·d)联合TOF治疗CIA模型具有显著的叠加效应,不仅能有效缓解关节炎症,还能减少骨侵蚀,抑制细胞焦亡。
协同增效,艾拉莫德联用托法替布促进骨保护作用
对于破骨细胞,Ying‑Xing Wu等人的研究报道,在卵巢切除诱导的骨质疏松症小鼠模型中,IGU治疗可抑制破骨细胞的分化途径,并显著减少骨小梁的骨质流失[5]。对于成骨细胞,Ke Gan等人的研究表明,IGU不仅能促进成骨细胞的分化,还可通过抑制炎症反应间接抑制成骨细胞损伤[6]。本研究证实,IGU可显著增加成骨细胞和破骨细胞数量,表明IGU在促进骨形成和抑制骨吸收方面发挥着重要作用。并且,IGU与TOF联合治疗时,成骨细胞的数量较单药治疗增加更为显著。
机制互补,艾拉莫德联用JAK抑制剂发挥多途径作用
IGU不仅能抑制IL-6和粒细胞巨噬细胞集落刺激因子(GM-CSF),还能抑制滑膜细胞和单核细胞中的TNF-α、IL-1β和IL-8。此外,Yu Wei等人的研究显示,IGU能明显降低RA患者滑膜成纤维细胞中由IL-6诱导的IL-17和基质金属蛋白酶-3(MMP-3)水平[7]。上述促炎细胞因子在RA的病理过程中发挥着重要作用,但它们并不直接参与JAK通路的调节。因此,IGU独特的作用模式可能与JAK抑制剂发挥互补作用[8]。

经过为期6周的IGU和/或TOF治疗,与CIA模型大鼠相比,IGU+TOF联合治疗可显著改善关节炎评分,减少滑膜组织中的炎性细胞浸润,以及降低血浆中IL-18、IL-1β和IL-6的水平。更重要的是,与CIA模型大鼠相比,IGU+TOF可显著减少细胞焦亡相关蛋白的表达,并且在体外研究中也观察到了一致的趋势。此外,IGU+TOF联合治疗还可显著缓解骨破坏,并提高骨转换率。总之,通过IGU+TOF的新型联合治疗方案,可以实现RA多方面的获益,包括减轻滑膜组织炎症和增生、降低细胞焦亡相关蛋白的表达水平以及缓解骨破坏。
仅供医疗卫生专业人士阅读
作者:YMT;
审校:张希贤,张莉娟,高加索,颜爱竹;
美编:王贤;
正文图片:改编自原文;

