【有言在先】逆转乾坤,巨块型肝癌术后达到pCR,龚连生教授谈免疫联合抗血管生成惊艳疗效!
*仅供医学专业人士阅读参考

巨块型原发性肝癌,免疫+抗血管生成3周期后获得手术切除机会!
原发性肝癌(PLC)是一种致命的恶性肿瘤,具有明显的组织学和生物学异质性,以起病隐匿,侵袭性强、死亡率高著称,严重威胁国民生命健康。2020年我国PLC新发病例数达41万例,占全球的45.27%;死亡病例数39万例,占全球的47.12%[1]。PLC的主要组织学类型分为肝细胞癌(HCC)、肝内胆管癌(ICC)和混合型肝细胞胆管癌(CHC),其中以HCC最为常见。HCC病因复杂,早期诊断困难,发现时往往已进入中晚期,导致其预后较差[1]。此外,HCC患者常常合并慢性肝炎和肝硬化,手术后复发率较高,这些都严重影响了HCC患者的预后和生存率。
近年来,免疫治疗成为继手术、化疗、放疗和靶向治疗后又一新的肿瘤治疗手段,以PD-1/PD-L1抑制剂为代表的免疫治疗药物打破了分子靶向药物的单一治疗格局,而免疫治疗联合抗血管生成治疗也逐渐成为晚期HCC的主要治疗手段之一。IMbrave150、ORIENT-32、SHR-1210-III-310以及CISLD-12等多项研究证实免疫治疗联合抗血管生成药物可提高HCC患者生存获益-5。
此前,中南大学湘雅医院李晓莉教授为我们分享了一例“恩沃利单抗联合仑伐替尼治疗晚期肝癌”的临床病例,结合此病例,医学界肿瘤频道特邀中南大学湘雅医院龚连生教授对晚期HCC临床诊疗现状以及此例患者治疗过程中的诊疗难点与亮点进行点评、讨论(采访整理文字在下文中)。
龚教授视频(采访整理文字在下文中)
患者信息
患者男,58岁。
现病史:患者2019年11月因“发现肝占位”在北京协和医院就诊,于11月13日全麻下行“腹腔镜下右肝联合肝段切除术”,术后病检为中分化肝细胞肝癌,术后具体诊治不详。患者于2022年10月无明显诱因下出现上中腹疼痛,为持续性绞痛,伴有双侧肩背部疼痛,不能自行缓解、食欲减退、纳差,于外院行CT检查提示肝左叶考虑肿瘤破裂出血可能,考虑诊断为“肝癌复发可能”,行对症支持治疗治疗(具体不详)后有所好转。
既往史:有乙型肝炎病史多年,3年前开始规律口服“丙酚替诺福韦 1片 每日一次(qd)”抗病毒治疗。
个人史:有吸烟史,30包/年,已戒烟半年,无饮酒史。余无特殊。
体格检查:体温:36.4℃,脉搏:53次/分,呼吸:18次/分,血压:121/76mmHg,体重:67公斤,右上腹有压痛。
血常规:白细胞(WBC):4.5×109/L,红细胞(RBC):4.06×1012/L,血红蛋白(Hb):129.0g/L,血小板(PLT):139×109/L。
肝肾功能:总蛋白(TP):77.8g/L,白蛋白(Alb):45.7g/L,总胆红素(TB):25.4μmol/L,直接胆红素(DB):8.7μmol/L,谷丙转氨酶(ALT):75.1U/L,谷草转氨酶(AST)77.3U/L。
凝血功能:血浆纤维蛋白降解产物(FDP):9.6mg/L,D-二聚体1.14mg/L。
乙肝病毒脱氧核糖核酸(HBV-DNA)滴度:533IU/ml,HBV-DNA定量:605.99IU/ml。
肿瘤标记物:异常凝血酶原(DCP):5923.0ng/ml,甲胎蛋白(AFP):696.5ng/ml,糖类抗原125(CA125):85.53U/ml,糖类抗原19-9(CA19-9):23.07U/ml,癌胚抗原(CEA):1.64ng/ml。
2022年11月8日外院中上腹磁共振成像(MRI):肝左叶新发肿块,考虑复发,并门脉主干及门脉左支多发癌栓形成;左肝内胆管扩张,肝脏下方考虑肿瘤破裂出血,粘液性包裹性积液;新发腹水。
2022年11月8日胸腹部盆腔增强CT:肝左叶考虑肿瘤破裂出血可能;腹膜多发结节,考虑种植转移;细支气管炎,肺气肿,肺大疱,双肺肺炎;右上肺考虑继发性结核;右中肺结节灶;甲状腺左侧低密度灶。
诊断:1、原发性肝癌(肝癌复发,肝癌破裂出血);2、病毒性肝炎慢性乙型
治疗经过:
与患者沟通病情,向患者告知目前指南推荐的一线方案。而患者治疗意愿不强,且当时处于疫情期间,患者不愿意接受需要反复入院的治疗方案,同意接受恩沃利单抗皮下注射+仑伐替尼口服方案。
治疗方案:1.谷胱甘肽:0.4g 一日三次(tid)口服(po)、仑伐替尼:8mg qd po;2.恩沃利单抗注射液:400mg 皮下注射(sc,2022年11月19日、2022年12月10日、2023年1月1日)。
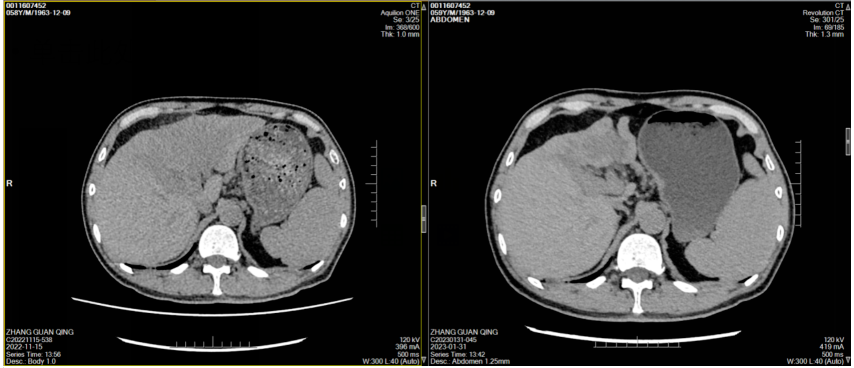
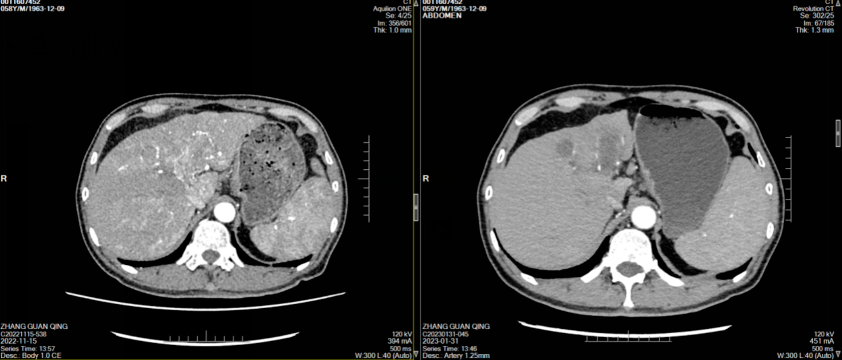
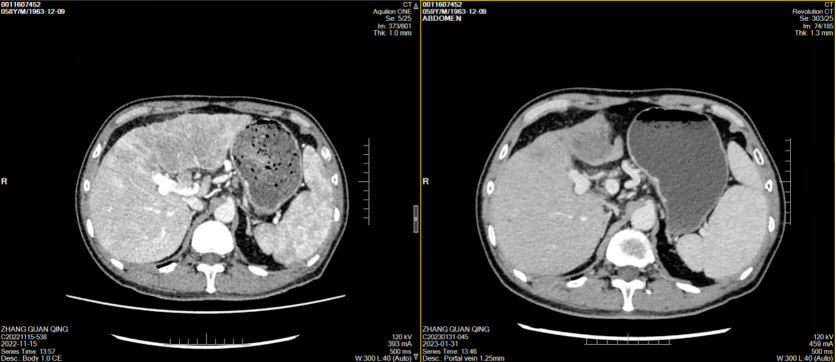
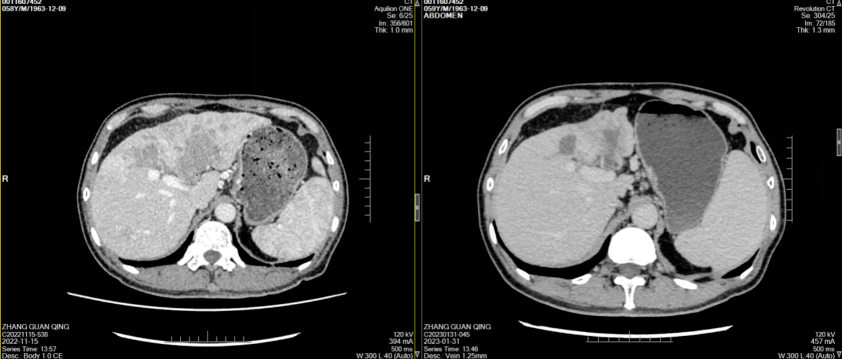
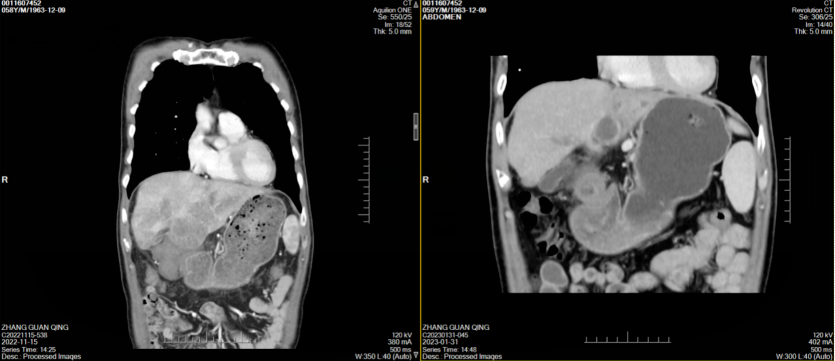
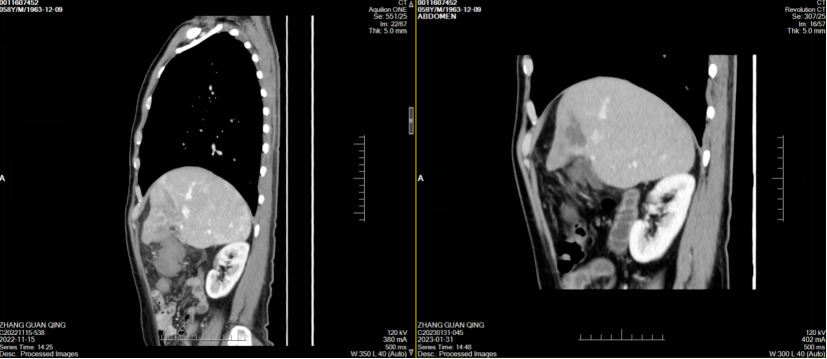
经治疗后患者腹痛症状好转,其后监测肿瘤标志物显著改善(图1),2023年1月31日复查CT示肝左叶肿块并出血伴肝内多发浸润性病变,考虑肝癌并肝内多发子灶、门脉癌栓,治疗后病变较前明显缩小、减少,门脉左支及其分支癌栓缩小;肝硬化、脾大、门脉高压症并侧支循环开放(食管下段-胃底静脉曲张),腹水,横结肠、升结肠、降结肠肠管壁水肿、腹膜水肿,余同前(图2-7)。
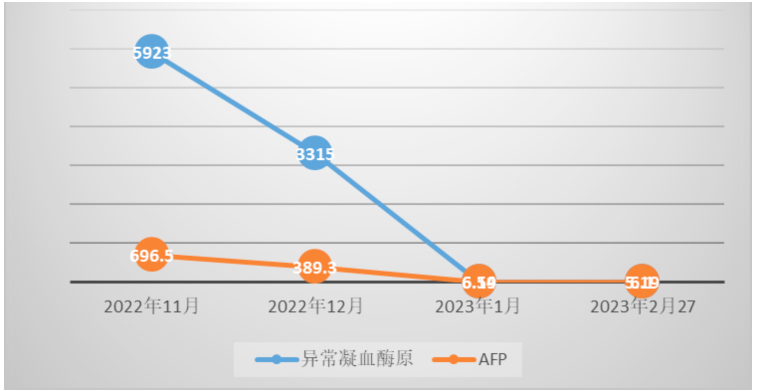
图1 患者肿瘤标记物变化
图2-5 患者两周期治疗前后CT横断位平扫、动脉期、门静脉期、静脉期图像对比(左右滑动)
图6,7 患者两周期治疗前后CT冠状位、矢状位图像对比(左右滑动)
患者经治疗后症状好转,表示愿意接受进一步治疗,于1月31日、2月27日继续给予恩沃利单抗400 mg sc,并持续服用仑伐替尼。2021年2月27日复查彩超示左肝内探及多个结节,较大者54 mm×31 mm,形态规则边界清,结节内未见明显血流信号。门静脉矢状支内充满低回声光斑,门静脉主干内径正常,管腔内血流通畅。提示肝硬化、脾大;左肝多发实质性结节;门静脉矢状支栓塞。
经评估后患者具备复发再次切除手术指征,与患者沟通后其接受再次手术治疗,2023年4月7日行腹腔镜下左肝切除+门静脉切除重建术。术后病理示(左肝肿物)送检见变性坏死组织,增生纤维组织,伴炎细胞浸润。患者术后恢复可,术后2周后继续予仑伐替尼+恩沃利单抗维持治疗。
病例总结
本例患者诊断为原发性肝癌(术后复发,肿块破裂出血),入院就诊时无再次手术指征。给予恩沃利单抗(sc)联合仑伐替尼(po)方案,3周期后复查显示患者的肿瘤标志物降至正常范围,影像检测显示患者病灶显著缩小,经评估患者可接受手术切除,给予腹腔镜下左肝切除+门静脉切除重建术,术后病理未见癌细胞,疗效评估为病理学完全缓解(pCR)。
专家点评
| 龚连生教授:
我国作为肝癌大国,肝癌患病总人数接近全球的一半,随着乙肝疫苗的推广,肝癌的患病率正在逐渐降低。目前肝癌最有效的治疗手段为外科治疗,然而由于肝癌起病隐匿,导致我国肝癌患者初诊时70%以上已处于中晚期,失去了外科根治的机会。即使是接受根治性切除的患者,年内总复发率也高达70%左右,复发后的患者大多失去再次手术治疗机会。因此,目前系统抗肿瘤治疗,尤其是基于免疫检查点抑制剂的联合治疗,已成为不可切除肝癌最常用和最主要的治疗手段[2]。
既往无法手术切除的患者对于化疗的疗效有限,患者的预后较差,然而现在免疫治疗、抗血管生成治疗等手段日益丰富,明显改善了患者的无进展生存期(PFS)和总生存期(OS)。IMbrave150、ORIENT-32、SHR-1210-III-310以及CISLD-12等多项研究证实免疫治疗联合抗血管生成药物可提高HCC患者生存获益-5。
IMbrave150研究-2显示,阿替利珠单抗联合贝伐珠单抗对治疗不可切除HCC,中位OS可达到19.2个月,中位PFS达到6.9个月,客观缓解率(ORR)为30%。在中国亚组人群更具疗效优势,联合治疗组OS达到24.0个月。CISLD-12研究[8]显示,恩沃利单抗联合仑伐替尼和肝癌动脉灌注化疗栓塞治疗(TACE)不可切除HCC,患者按RECIST v1.1和mRECIST标准评估的ORR分别为36.1%和77.8%,疾病控制率(DCR)分别为77.8%和80.6%。
3年前,该患者曾因肝癌于外院行“右肝肿瘤切除术”,此次发病,影像检查提示为巨块型肝癌并破裂出血,考虑复发,由于患者肿瘤较大,占据肝脏的2/3,肿瘤界限不清晰,且肝内多发子灶、肝左叶胆管受累继发肝左叶胆管扩张、门静脉右支、门脉左支及其分支癌栓形成。因此,患者此次入院就诊时已无手术指征。该患者对治疗丧失信心,拒绝接受介入治疗,此外,由于当时疫情较为严重,经常往返医院较为困难,因此对于治疗方案的便捷性要求较高。本例患者采取了恩沃利单抗联合仑伐替尼的治疗方案,恩沃利单抗皮下注射的给药方式以及仑伐替尼的口服给药方式,不仅满足了患者对治疗便捷性的需求,其疗效也得到了临床研究的确证。
该患者用药1周期后,自觉精神状态、食欲等均好转,复查肿瘤标志物显著下降,因此继续用药2周期,共计用药3周期后复查,显示患者的肿瘤标志物降至正常范围且肿瘤明显缩小,经过了肝功能以及残余肝体积的评估后,认为该患者可以接受手术治疗,给予腹腔镜下左肝切除+门静脉切除重建术。术后病理切片显示患者门静脉癌栓中未见癌细胞,疗效评估为pCR。该患者目前术后恢复良好,极大改善生活质量,多次复查均显示无复发。该病例再次确证了恩沃利单抗联合仑伐替尼的有效性,为患者带来了治愈希望。
针对免疫+抗血管生成的治疗模式,目前已经有诸多研究探索了其联合治疗的优势。抗血管生成药物通过阻断VEGF通路诱导血管正常化和改善免疫微环境,增加药物递送效率,增强效应免疫细胞浸润;同时,其本身也有抑制血管内皮细胞增殖、迁移、侵袭的抗肿瘤血管新生的作用。PD-1/PD-L1抑制剂可以重新激活T细胞,恢复其杀伤功能[9,10]。从联合治疗角度来讲,抗血管生成药物与PD-1/PD-L1抑制剂可共同作用于肿瘤微环境,重塑肿瘤血管微环境和免疫微环境,使免疫抑制状态转化为免疫促进状态,增加T细胞对肿瘤的浸润,发挥”1+1>2”的协同抗肿瘤作用[9,10]。目前《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南2022》中已将多种“免疫治疗联合抗血管生成治疗”方案列为晚期HCC一线治疗方案,其中部分方案被列为Ⅰ级推荐[11]。
目前对肝癌的治疗以联合治疗为主,除了免疫+抗血管的联合模式以外,还有放疗、TACE、肝动脉化疗灌注术(HAIC)等多种手段,未来仍需进一步探索不同联合治疗方案,例如双免联合治疗、手术联合免疫治疗、介入联合免疫治疗、放疗联合免疫治疗等,找到更多更适合国内患者的治疗方案。
目前肿瘤领域已经步入了精准治疗时代,我们未来还需要探索更多晚期HCC免疫治疗相关生物标志物,例如PD-L1表达、肿瘤突变负荷(TMB)、微卫星不稳定性、特异性基因改变、外周血生物标志物以及肠道微生物等,从而为患者提供更加精准的用药策略,并且根据患者基本情况、家庭经济状况以及疾病的耐受、肝功能等多方面因素综合考虑,选择不同的治疗策略,帮助更多患者改善预后。

龚连生 教授
-
医学博士,博士生导师,教授,主任医师
-
中南大学湘雅医院湘雅医院肝胆胰外科主任
-
湖南省医学会普通外科专业委员会胰腺外科学组组长
-
湖南省医学会肿瘤学专业委员会胰腺肿瘤外科学组副组长
-
湖南省抗癌协会胆道肿瘤专业委员会副主任委员
-
湖南省肝胆胰联盟副理事长
-
湖南省抗癌协会肝癌专业委员会常务委员
-
湖南医学会内镜专业委员会常务委员
-
中国医师协会内镜医师分会委员
-
中国NOSES联盟湖南分会名誉理事长
-
国家重点研发计划重点专项评审专家
-
中国内镜杂志、中国现代医学杂志、中国医学工程杂志常务编委。
-
主持国家863计划项目:3项。主持国家科技部支撑项目:1项。并参与国家级省部级课题10余项。发表以第一作者及通讯作者的SCI论文12余篇,国内核心期刊等发表论文130余篇。

-
普外科,副主任医师,外科学博士
-
中国医师协会内镜医师分会委员
-
WEDA常务理事兼华中地区秘书长
-
湖南医学会内镜专业委员会委员
-
中国非公立医疗机构协会胆石病专业委员会委员
-
参与多次国家级大会上演示腹腔镜胰十二指肠切除手术及手术直播,获得2019年美刀规范化手术视频大赛全国总决赛二等奖,2019年作为普外专培基地国家级专培导师。2019年获得省级优秀带教老师。获得校级新技术奖二等奖一项,院级新技术奖二等奖2项,目前发表论文10余篇;已授权专利1项,主持省级自然科学基金项目2项,参与国家级课题2余项。
参考文献:
[1]鲜林峰,方乐天,刘文斌,等.原发性肝癌流行现状、主要发病机制及防控策略[J].中国癌症防治杂志,2022,14(3):320-328.
[2]国际肝胆胰协会中国分会,中华医学会外科学分会肝脏外科学组,中国临床肿瘤学会(CSCO)肝癌专家委员会. 肝细胞癌免疫联合治疗多学科中国专家共识(2023版). 中华肝脏病杂志,2023,31(01):16-34.
[3]Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma[J]. N Engl J Med, 2020, 382(20): 1894-1905.
[4]Cheng AL, Qin S, Ikeda M, et al. Updated efficacy and safety data from IMbrave150: atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma[J]. J Hepatol, 2022, 76(4): 862-873.
[5]Finn RS, Qin S, Ikeda M, et al. IMbrave150: updated overall survival (OS) data from a global, randomized, open-label phase III study of atezolizumab (atezo) + bevacizumab (bev) versus sorafenib (sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC)[J]. J Clin Oncol, 2021, 39(3_suppl): 267.
[6]Ren Z, Fan J, Xu J, et al. Sintilimab plus a evacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study[J]. Lancet Oncol, 2021, 22(7):977-990.
[7]Qin S, Chan LS, Gu S, et al. LBA35-Camrelizumab plus rivoceranib vs. sorafenib as first-line therapy for unresectalbe hepatocellular carcinoma: a randomized, phase 3 trial[J]. Ann Oncol, 2022, 33 Suppl 7: S808-869.
[8]Liang TB, Chen YW, Huang X, et al. Efficacy and safety of envafolimab plus lenvatinib combined with TACE in unresectable hepatocellular carcinoma: An open-label, single-arm, phase 2 study—The CISLD-12 study[J]. J Clin Oncol, 2023, 41(4_suppl): 558.
[9]Fukumura D, Kloepper J, Amoozgar Z, et al. Enhancing cancer immunotherapy using antiangiogenics: opportunities and challenges[J]. Nat Rev Clin Oncol. 2018,15(5):325-340.
[10]Pinter M, Jain RK, Duda DG. The Current Landscape of Immune Checkpoint Blockade in Hepatocellular Carcinoma: A Review[J]. JAMA Oncol. 2021,7(1):113-123.
[11]《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南2022》