谢伟林教授:相得益彰,锦上添花,托法替布联用艾拉莫德治疗RA-ILD的疗效研究
*仅供医学专业人士阅读参考

类风湿性关节炎(RA)是一种以侵蚀性关节炎为主要临床表现的自身免疫性疾病,可破坏关节软骨和骨,最终导致关节畸形和功能丧失[1]。除此之外,肺部也是经常受累的脏器之一,间质性肺炎(ILD)是RA常见的肺部并发症,见于约30%的RA患者[2]。在ILD亚型中,普通型间质性肺炎(UIP)是最为主要的病理类型[3]。
RA相关UIP(RA-UIP)作为一种严重的并发症,其疾病特点为蜂窝状斑片异质纤维化和活跃的成纤维细胞灶[4]。患者最初可能会出现呼吸困难和干咳,随着病情进展,呼吸困难会变得越来越严重,最终可能需要进行肺移植。目前在临床上,尚无治疗RA-UIP的特效药物。疾病进展及其严重程度是决定治疗方案时要考虑的两个主要因素,而糖皮质激素和免疫抑制剂是治疗RA-UIP的常用药物[5]。
就在近期,一项由青岛大学医学院附属烟台毓璜顶医院风湿科谢伟林教授牵头,首次探讨托法替布联用艾拉莫德(IGU)治疗RA-UIP的疗效与安全性相关研究公布,引起外界热烈关注和讨论。借此契机,医学界邀请到谢伟林教授就RA-UIP的临床治疗问题进行深入交流,旨在为临床医生们提供更好的治疗思路和临床依据。
RA-UIP是RA患者中最常见的肺部并发症之一。由于RA本身的慢性炎症和免疫异常,患者易患肺部疾病,其中RA-UIP是最常见和严重的类型。RA-UIP患者具有更高的肺功能下降率和更高的死亡率,生存时间也更短[6]。谢伟林教授为此强调到:“由于RA-UIP存在发病率高,预后不好,治疗选择太少的现象,且激素和免疫制剂对该病治疗效果并不显著,因此如何寻找更有效的治疗方案,是一个亟待解决的问题。”
RA-UIP可对患者的健康状况和预后产生显著影响,可导致肺部纤维化和气体交换功能受损,部分患者甚至需要肺移植等重大干预治疗,严重影响患者的呼吸功能和生活质量。谢伟林教授表示:“目前尚缺乏关于RA-UIP最佳治疗策略的共识。传统的免疫抑制药物如甲氨蝶呤(MTX),对RA-UIP的治疗效果也有限。因此,寻找更有效的治疗方法对于改善患者的预后至关重要。”
面对这些挑战,风湿免疫专科研究需要进一步探索RA-UIP的病因、发病机制和治疗方法。通过加强对RA-UIP的深入研究,我们可以提高对该疾病的认识,改进诊断标准,发现新的治疗靶点,并为患者提供更好的治疗选择,以改善其生活质量和预后。
托法替布是首个JAK通路抑制剂,能降低炎性因子表达,延缓疾病发展。它适用于MTX疗效不足或对其无法耐受的中度至重度活动性RA成年患者;IGU作为免疫调节剂类抗风湿药物,不仅作用于T淋巴细胞,也作用于B淋巴细胞,调节免疫平衡,还通过抑制典型的炎症相关信号通路发挥抗炎作用,IGU可以下调循环中前炎症因子及部分炎症因子的水平,从而减轻全身炎症,改善患者整体状态[7]。这两种药物的不同作用机制可以在多个通路上发挥作用,增加治疗效果。
目前也有研究发现,IGU可能是肺纤维化的一种有效治疗策略[8,9]。体内和体外研究结果也表明,托法替布可以减缓结缔组织疾病相关ILD的进展[10],是一种潜在的用于RA-UIP的治疗选择。
基于上述药物的作用机制,谢伟林教授制定了一套联合治疗方案:“托法替布联合IGU治疗RA-UIP,做到兼顾RA治疗和稳定UIP的纤维化进展,并展开临床探索。选择这两个药物联合使用还有一个重要的原因,就是它们都在治疗RA的一个适应症里面,不存在超适应症用药的问题”。
谢伟林教授就托法替布联合IGU治疗RA-UIP这一课题,开展了一项单中心、前瞻性、观察性队列研究[11]。该研究纳入52例RA-UIP患者,其中有24例接受托法替布(5mg,每日两次)联合艾拉莫德(IGU)治疗,28例接受MTX/来氟米特(LEF)和传统合成改善病情抗风湿药(csDMARDs)治疗,并对其进行为期6个月的随访。
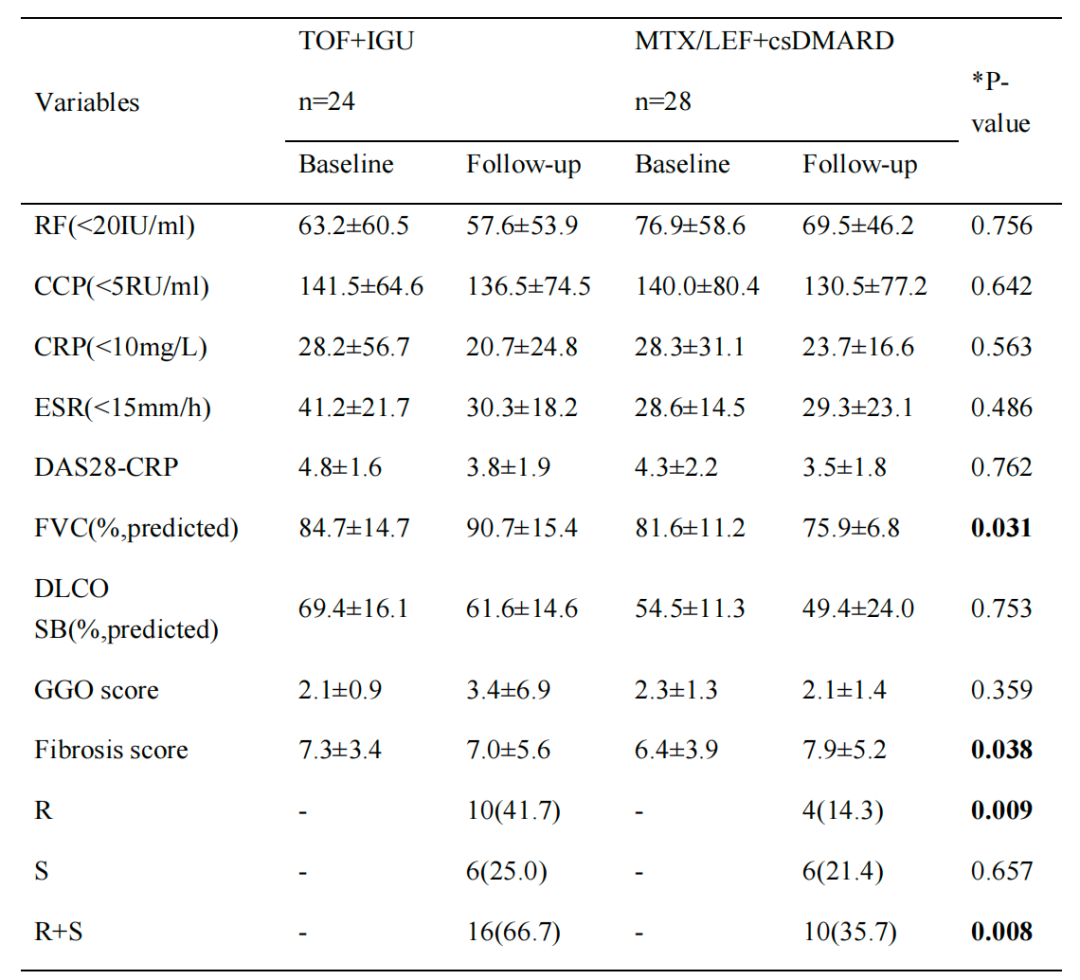
本研究通过评估临床相关的治疗反应来确定不同治疗方案的疗效(表1)。具体而言,与基线相比,治疗反应是基于C-反应蛋白的28个关节疾病活动评分(DAS28-CRP)和高分辨率计算机断层扫描(HRCT)评分的下降程度来评估的。如果HRCT评分增加或减少>10%,则被定义为疾病恶化或消退,变化小于10%则被定义为稳定。
研究结果显示,托法替布联合IGU治疗组的DAS28-CRP评分显著低于基线水平(4.8±1.6 vs. 3.8±1.9),但与MTX/LEF联合csDMARDs治疗组相比,两组之间没有显著差异(P=0.762)。
托法替布联合IGU治疗组的用力肺活量百分比(FVC%)在6个月后得到明显改善,相对于MTX/LEF和csDMARDs治疗组,其变化程度更加显著(-1.89±2.33,P=0.031)。托法替布联合IGU治疗组HRCT纤维化评分改善明显(-0.17±2.52),显著优于MTX/LEF和csDMARDs治疗组(1.36±2.42,P=0.038)。在托法替布联合IGU治疗组,有10例患者(10/24,41.7%)表现出消退,6例患者(6/24,25.0%)稳定,8例患者(8/24,33.3%)表现出RA-UIP恶化。在MTX/LEF和csDMARDs治疗组,有18例患者(18/28,64.3%)表现出恶化,6例患者(6/28,21.4%)稳定,4例患者(4/28,14.3%)表现消退。托法替布联合IGU治疗组的治疗反应(消退+稳定)显著高于MTX/LEF和csDMARDs治疗组,分别为66.7%(16/24)和33.5%(10/28)(P=0.008)。
相较于MTX/LEF加上传统疾病修饰抗风湿药(csDMARDs),托法替布联用IGU在治疗RA-UIP方面获得更高的治疗反应率的原因可能包括以下几个方面:1)作用机制不同:托法替布通过抑制JAK1和JAK3的活性来减轻炎症和关节症状;IGU则是通过抑制细胞因子和免疫球蛋白来控制RA。这两种药物的不同作用机制可能使其能够针对RA-UIP的多个病理过程产生协同效应,从而提高治疗反应率;2)强化的免疫抑制效应:这对于RA-UIP患者尤为重要,因为该疾病涉及到RA和UIP的双重病理过程。免疫抑制可以减少炎症反应、控制自身免疫攻击,从而减轻关节和肺部的病变;3)更好的疾病控制:托法替布联用IGU能够更好地控制RA-UIP的疾病活动性,更快地缓解症状、减轻关节肿痛、改善肺部功能等。相比于MTX/LEF加上csDMARDs的传统治疗方案,托法替布联用IGU可能提供更全面、更有效的疾病控制。
谢伟林教授总结道:“上述结果提示,托法替布联合IGU可以同时缓解RA和RA-UIP,并且在RA-UIP治疗反应方面优于MTX/LEF和csDMARDs。因此,托法替布联合IGU可能是实现双重治疗目标的潜在选择。”
表1:临床、肺功能和HRCT评分数据,基线和随访的显著性水平,以均值和标准差或数字表示(百分比,%)。CCP:抗环葡氨酸肽,RF:类风湿因子,CRP:C反应蛋白,ESR:红细胞沉降率,DAS:疾病活动性评分,PGA:医生整体可及性,TLC:总肺活量,FVC:用力肺活量,DLCO SB:一氧化碳扩散能力单呼吸法,GGO:磨玻璃不透明度,R:回归,S:稳定,*P<0.05:治疗6个月后两组与基线相比变化差异有统计学意义
托法替布联用IGU药物的协同作用机制可能使其能够针对RA-UIP的多个病理过程产生协同效应,从而获得更高的治疗反应率。除此之外,该药物联用在治疗RA-UIP方面还具有哪些临床获益,这是广大临床医生和患者都想了解的,对此,谢伟林教授谈到三点获益:“第一,该联合用药不加重患者的疾病负担和经济负担;第二,该联合用药在治疗RA这一原发疾病的同时,可有效稳定UIP的纤维化进展,实现抗炎和抗纤维化的双达标的治疗目的;第三,可不需要加用或推迟加用额外的抗纤维化治疗方案”。
虽然托法替布联用IGU的优势很多,但谢伟林教授仍表示还需要进一步的研究来完善治疗认知:“目前还需要进行更多的研究来确定托法替布联用IGU是否可以作为未来治疗RA-UIP的标准治疗方案之一。尽管目前的研究表明,这种组合治疗可以显著改善RA-UIP患者的症状和疾病活动性,但这些研究的样本量相对较小,治疗时间相对较短,且缺乏长期的随访数据。”此外,RA-UIP的临床特征和疾病进展可能与其他类型的RA和ILD存在差异。因此,需要进一步的研究来确定托法替布联用IGU是否是RA-UIP患者的最佳治疗选择,并评估其长期的疗效和安全性。
总之,托法替布联用IGU在治疗RA-UIP方面表现出良好的潜力,但仍需要进行更多的研究来确定其在未来作为治疗RA-UIP的标准治疗方案中的地位。

-
烟台毓璜顶医院 -
临床医学博士,副主任医师
-
山东省医师协会风湿免疫学医师分会第二届委员
-
山东省健康管理协会呼吸病学专业委员会首届委员
-
先后发表SCI论文及核心期刊论文十余篇
-
主研中华医学会专项基金课题1项
-
参研国家自然科学基金项目2项
-
荣立个人三等功2次
-
获济南军区保健委员会二等奖1次
-
评为滨洲医学院教学基地优秀教师2次
-
军队医院优秀基层干部1次
参考文献:
[1]耿魁魁,史天陆,沈爱宗,张圣雨.新型生物和靶向制剂治疗难治性类风湿关节炎的研究进展[J].中国药房,2021,32(22):2807-2813.
[2]杨晓燕,沈杰.类风湿关节炎相关间质性肺疾病的诊治研究进展[J].中国中医急症,2016,25(01):102-105.
[3]中国医师协会呼吸医师分会呼吸病理工作委员会. 普通型间质性肺炎病理诊断中国专家共识(草案)[J]. 中华结核和呼吸杂志, 2018, 41(3):5.
[4]王聪颖,韩蕊,李晶芳,殷宏庆,樊佳佳,杨珍,宋丽丽,张艳军.类风湿关节炎相关间质性肺病发病机制、诊断及治疗研究进展[J].天津中医药大学学报,2022,41(02):250-257.
[5]赵张燕,慕永平.类风湿关节炎相关间质性肺病药物治疗现状和进展[J].医学理论与实践,2022,35(05):755-758.
[6]Wu E K, Ambrosini R D, Kottmann R M, et al. Reinterpreting evidence of rheumatoid arthritis-associated interstitial lung disease to understand etiology[J]. Current rheumatology reviews, 2019, 15(4): 277-289.
[7]Xu Y, Zhu Q, Song J, et al. Regulatory effect of iguratimod on the balance of Th subsets and inhibition of inflammatory cytokines in patients with rheumatoid arthritis[J]. Mediators of Inflammation, 2015.
[8]Zhao L, Mu B, Zhou R, Cheng Y, Huang C. Iguratimod ameliorates bleomycin-induced alveolar inflammation and pulmonary fibrosis in mice by suppressing expression of matrix metalloproteinase-9. Int J Rheum Dis. 2019;22(4):686-694.
[9]Jiang H, Gao H, Wang Q, Wang M, Wu B. Molecular mechanisms and clinical application of Iguratimod: A review. Biomed Pharmacother. 2020;122:109704.
[10]Sendo S, Saegusa J, Yamada H, Nishimura K, Morinobu A. Tofacitinib facilitates the expansion of myeloid-derived suppressor cells and ameliorates interstitial lung disease in SKG mice. Arthritis Res Ther. 2019;21(1):184.
[11]Weilin Xie, Shuhua Wang, Yao LI. Clinical efficacy and safety of tofacitinib combined with iguratimod for rheumatoid arthritisassociated usual interstitial pneumonia.

