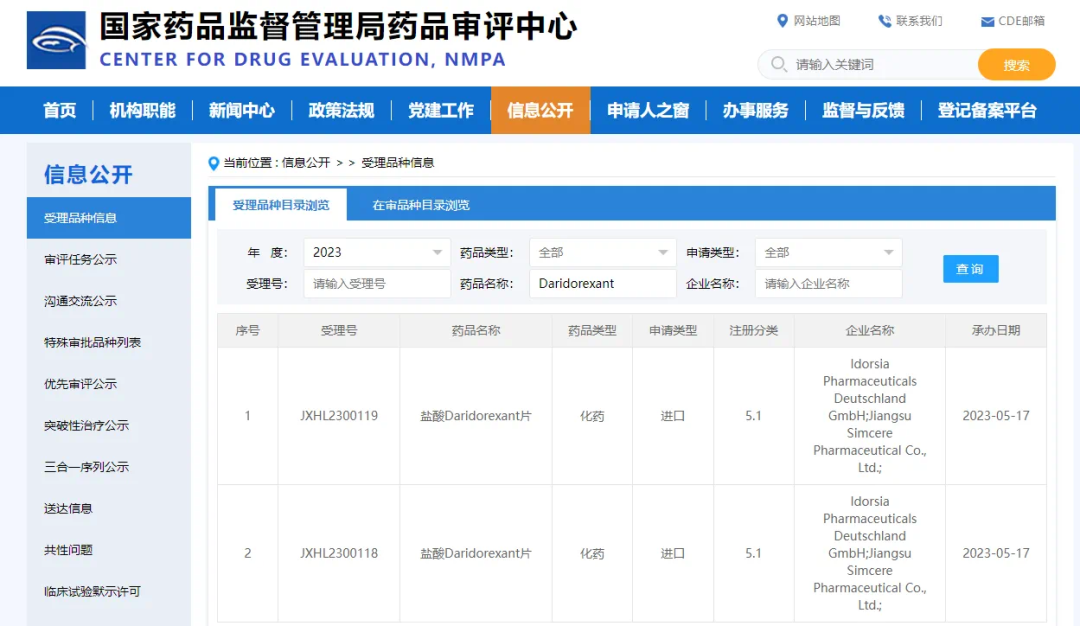
先声药业新一代抗失眠药双食欲素受体拮抗剂临床试验申请获受理

2023年5月16日,先声药业(2096.HK)与瑞士Idorsia公司合作的新型抗失眠药物Daridorexant的临床试验申请(IND)已获国家药品监督管理局药品审评中心(CDE)受理,拟用于治疗成人失眠患者。其海外III期临床数据显示,在接受1个月、3个月治疗后,Daridorexant组患者相较安慰剂组入睡更快,夜间睡眠增加近1小时,日间精神状态更佳,且未发现耐受性、依赖性、反跳性失眠、戒断症状和药物滥用证据。
失眠是目前带来广泛困扰的一项疾病,临床症状多表现为入睡困难和/或睡眠维持困难。2017年一项对于中国普通人群失眠患病率的荟萃分析显示,中国失眠患病率约为15%[1],上亿人口受慢性失眠困扰。失眠人群对可以改善睡眠量及睡眠质量,提高日间功能的创新药有强烈需求。
Daridorexant为一种双食欲素受体拮抗剂(海外商品名QUIVIVIQ),与传统失眠药物作用机制不同,Daridorexant靶向性更强,通过拮抗食欲素受体,从而降低觉醒刺激,诱导睡眠发生,并且不改变患者的睡眠结构。

Daridorexant海外商品QUIVIVIQ示意图
Daridorexant由瑞士领先的生物制药公司 Idorsia研发。此前已分别获美国食品和药物管理局(FDA)、欧洲药品管理局(EMA)、瑞士药品监督管理局(Swissmedic)批准,在美、英、瑞士上市,是欧洲第一个获批的双食欲素受体拮抗剂。2022年11月,先声药业与 Idorsia签订独家许可协议,获得大中华地区(中国大陆、香港、澳门)临床开发和商业化daridorexant的独家权利。
综合提升睡眠质量

DaridorexantIII期临床数据发表于《柳叶刀-神经病学》
接受Daridorexant50mg治疗的受试者,在治疗的第三个月,持续睡眠潜伏期(LPS)显著下降34.8分钟,入睡后醒来时间(WASO)显著下降29.4分钟,自我报告的总睡眠时间(sTST)显著增加57.7分钟[2]。以此计算,服用Daridorexant的患者每周相当于增加近一整晚的睡眠。
有效改善日间功能
Daridorexant另一显著优势是可有效改善日间功能,是唯一被欧洲药品管理局(EMA)批准的改善日间功能的失眠药。日间功能可理解为日间嗜睡、疲乏情况,精神或情绪状态、认知功能等。Daridorexant的海外III期临床数据显示,根据美国食品药品监督管理局(FDA)行业指南开发和验证的失眠日间症状和影响问卷(IDSIQ)评估,50mg剂量组在第1个月和第3个月的日间嗜睡维度具有显著的统计学改善。
同时,III期临床研究数据也显示出该药物良好的安全性,9个月的扩展研究安全性与关键Ⅲ期一致。总体不良事件发生率低,各治疗组一致,且未显示出耐受性、依赖性、反跳性失眠或戒断反应的证据。
Daridorexant预计在2023年8月取得CDE临床试验批准通知书,先声药业将秉持“让患者早日用上更有效药物”的企业使命,在IND获批后将进一步加速研发,为国内失眠患者早日带来失眠更佳疗法。

参考文献
1.Cao, X. L., Wang, S. B., Zhong, B. L., Zhang, L., Ungvari, G. S., Ng, C. H., Li, L., Chiu, H. F., Lok, G. K., Lu, J. P., Jia, F. J., & Xiang, Y. T. (2017). The prevalence of insomnia in the general population in China: A meta-analysis. PloS one, 12(2), e0170772. https://doi.org/10.1371/journal.pone.0170772
2.Mignot E, Mayleben D, Fietze I, Leger D, Zammit G, Bassetti CLA, et al. Safety and efficacy of daridorexant in patients with insomnia disorder: results from two multicentre, randomised, double-blind, placebo-controlled, phase 3 trials. Lancet Neurol. 2022;21(2):125–39. https://doi.org/10.1016/S1474-4422(21)00436-1.

